
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

III. Операционно-познавательный этап. Задача учителя: ознакомить учащихся с понятиями «молярный объем газов», обозначением данной величины и сформировать умение решать задачи с использованием этих
|
|
Задача учителя: ознакомить учащихся с понятиями «молярный объем газов», обозначением данной величины и сформировать умение решать задачи с использованием этих понятий.
Изучение нового материала проводим с использованием поисковых методов обучения в сочетании с дедуктивными методами: от вывода формулы, выражающей зависимость между молярной массой и молекулярным объемом к решению частных задач.
Выясняем вопрос (опираясь на знания учащихся по физике): какую зависимость можно установить между массой вещества и объемом, который занимает это вещество?
V = 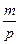
Предлагаем заменить m на M и получаем формулу:
Vm = 
Vm – молярный объем (объем одного моля), его выражают в м3/моль.
Предлагаем учащимся, пользуясь справочными данными рассчитать молярный объем для воды (Н2О) и серной кислоты (H2SO4).
| Химическая формула | Агрегатное состояние при н.у. | Молярная масса (М) | Плотность вещества (ρ) | Молярный объем (V m) |
| Н2О | ж | 18г/моль | 1000г/дм3 | |
| H2SO4 | ж | 98г/моль | 1980г/дм3 |
Vm (Н2О) = 0,018 дм3/моль
Vm (H2SO4) = 0,053 дм3/моль
Далее акцентируем внимание учащихся на газообразном состоянии вещества. Выясняем: какое влияние оказывают температура и давление на свойства газов? Делаем вывод, что при вычислении Vm следует оговорить, что газы находятся при определенных условиях, т.е. нормальных условиях:
t = 00C; p = 101,325кПа.
Предлагаем учащимся рассчитать молярный объем некоторых газов (Н2; О2; СО2), используя карточку-задание.
| Формулу вещества (в скобках указан вариант) | Молярная масса (М) | Плотность при н.у. (ρ) | Молярный объем (Vm) |
| Н2 (1 вариат) | ≈ 2 г/моль | 0,09 г/дм3 | |
| O2 (2 вариат)) | ≈ 32 г/моль | 1,43 г/дм3 | |
| CO2 (3 вариат)) | ≈ 44 г/моль | 1,97 г/дм3 |
Vm (Н2) ≈ 22,4 дм3/моль
Vm (О2) ≈ 22,4 дм3/моль
Vm (СО2) ≈ 22,4 дм3/моль
Записываем ответы на доске и сравниваем. Учащиеся делают выводы: Vm применяют только для газов, т.к. при н.у. Vm (всех газов) 22,4 дм3/моль. Демонстрируем учащимся куб 22,4 дм3. Делаем вывод, молярный объем Vm находится по отношению объема порции газа(V) к соответствующему количеству вещества этой порции:
Vm = 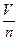 , отсюда n =
, отсюда n = 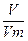 ; V = Vm • n
; V = Vm • n
Date: 2015-11-15; view: 549; Нарушение авторских прав