
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 9
|
|
“Корозія металів”
Мета роботи: Ознайомитися з теоретичними основами корозії металів, хімізмом перебігання газової і електрохімічної корозії, продуктами корозії і їх впливом на процес корозійного руйнування. Дослідити експериментально корозійне руйнування металу.
1. Теоретичні основи. Корозією звуть самовільне руйнування металів внаслідок хімічної або електрохімічної взаємодії з навколишнім середовищем. За механізмом процесу взаємодії метала з середовищем розрізняють хімічну корозію і електрохімічну корозію.
Хімічною корозією металу звуть самовільну взаємодію металу з корозійним середовищем при якому окислення металу і відновлення окислювача відбувається одночасно, у одному акті і просторово не розділені. Цей тип корозії має місце при взаємодії металу з сухими газами(повітрям, продуктами спалювання пального і іншими при високих температурах). Зміна поверхні металів у повітрі пояснюється тим, що їх поверхня вкривається тонким шаром оксидів – продуктів взаємодії металу з киснем повітря:
+n -2
mMe + (mn/2)O  MemOmn/2.
MemOmn/2.
При підвищенні температури цей процес прискорюється. Утворена плівка може мати захисні властивості – бути спроможною уповільнювати проникнення окислювача і металу один до одного, і в цьому випадку гальмувати процес корозії.
Зрозуміло, що плівка буде мати захисні властивості тільки у тому разі, якщо вона утворює шар сполуки металу з окисником, який є суцільним, не має пор і має добре зчеплення з поверхнею металу. Спроможність утворення такої плівки визначається умовою суцільності: молекулярний об’єм сполуки, яка утворюється з металу і окислювача - Vок, повинен бути більшим об’єму металу - VМе, який витрачається на утворення однієї молекули цієї сполуки. Таким чином, якщо Vок/VМе  1, плівка може бути суцільною і мати захисні властивості. В іншому випадку, якщо Vок/VМе
1, плівка може бути суцільною і мати захисні властивості. В іншому випадку, якщо Vок/VМе  1, плівка не може бути суцільною, вона має низькі захисні властивості і такий метал характеризується високою швидкістю окислення. Для оксидів Феруму це відношення дорівнює FeO - 1,77; Fe3O4 - 2,09 Fe2O3 - 2,14 і плівки вважаються захисними. Їх захисна дія крім умови суцільності, буде залежати від їх товщини і властивостей оксидів, які утворюються. Утворення плівок на поверхні металу можливо спостерігати по кольорам мінливості, виникнення яких обумовлено погашенням світла певної довжини хвилі внаслідок інтерференції двох променів світла з довжиною
1, плівка не може бути суцільною, вона має низькі захисні властивості і такий метал характеризується високою швидкістю окислення. Для оксидів Феруму це відношення дорівнює FeO - 1,77; Fe3O4 - 2,09 Fe2O3 - 2,14 і плівки вважаються захисними. Їх захисна дія крім умови суцільності, буде залежати від їх товщини і властивостей оксидів, які утворюються. Утворення плівок на поверхні металу можливо спостерігати по кольорам мінливості, виникнення яких обумовлено погашенням світла певної довжини хвилі внаслідок інтерференції двох променів світла з довжиною 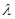 , які накладаються один на одного при проходу скрізь прозору плівку на металі.
, які накладаються один на одного при проходу скрізь прозору плівку на металі.
Електрохімічна корозія характерна у випадках, коли є контакт металу з розчином або плівкою електроліту. При цьому окислення металу перебігає не в одну стадію, а має місце два процеси, які просторово розділені але в той же час спряжені:
Анодний процес розчинення(окислення) металу і перехід його у розчин у вигляді іонів:
Me – ne = Men+.
Катодний процес відновлення речовини, яка здатна виступати у ролі окислювача, так званого деполяризатора. У кислому середовищі окислювачем може бути гідроген(корозія перебігає з водневою деполяризацією):
2H+ + 2e = H2.
У нейтральному і лужному середовищі окислювач – оксиген(корозія перебігає з кисневою деполяризацією):
O2 + 2H2O + 4e =4OH-

|
|
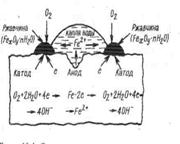
Електрохімічна корозія у більшості аналогічна роботі короткозамкненого гальванічного елементу, анодний процес у якому перебігає на більш активному металі. Різниця між ними у відсутності при корозії зовнішнього кола і електрони не виходять із металу, а рухаються у ньому. Вона виникає не тільки при наявності двох металів, але і при наявності на поверхні одного і того ж металу зон, які відрізняються по хімічним і фізичним властивостям. Неоднорідність поверхні, домішки інших металів або неметалів сприяють перебіганню електрохімічної корозії. Різноманітні включення по відношенню до металу є більш позитивними, тому вони виконують роль катоду – на їх поверхні відновлюється деполяризатор. Метал є катодом і він переходить у іонний стан – метал окислюється(схема 9.1). Таким чином при корозії
Схема 9.1 - Корозія сталі при Схема 9.2 - Корозія сталі
наявності неоднорідності при контакті з водою,
(приклад водневої деполяризації) (приклад кисневої деполяризації)
працює велика кількість корозійних елементів. Оскільки анодом повинен бути елемент з більш негативним потенціалом, то умова електрохімічної корозії:
Еметал 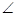 Едеполярізатор
Едеполярізатор
Потенціал водневого електроду Е = -0,059рН(при Р=1атм), кисневого електроду Е = 1,23 – 0,059рН(при Р = 1 атм). Таким чином потенціал деполяризатору буде залежати від тиску(водню, або кисню) і рН розчину.
Захист металів від корозії. Усі методи захисту металів від корозія умовно підрозділяють на такі групи:
1.Легування металів, коли у склад сплаву вводять компоненти, які сприяють збільшенню корозійної стійкості внаслідок пасивації металу і утворення на ньому захисних плівок. В якості легуючих елементів використовують хром, нікель, алюміній, силіціум та інші метали.
2.Захисні покриття і плівки ізолюють метал від навколишнього середовища. Захисні покриття можуть бути неметалевими(емалювання, лакофарбові, покриття смолами, пластмасами, полімерними плівками, гумою). Утворення на поверхні металу захисних оксидних плівок зветься оксидуванням, а фосфатних плівок – фосфатуванням. Матеріалами для металевих захисних покривів можуть бути як чисті метали(цинк, кадмій, алюміній, купрум, хром, нікол, аурум), так і їх сплави(бронза, латунь). За своєю поведінкою при корозії металеві покриття підрозділяють на катодні і анодні.Потенціал катодних покриттів у даному середовищі більш позитивний ніж основного металу. По відношенню до сталі к ним відносяться нікол, купрум. При руйнуванні цього покриття виникає корозійний елемент, у якому основний матеріал – анод і він руйнується. Катодні покриття, таким чином захищають метал при відсутності пор і неушкодженій поверхні. До анодних відносяться метали, потенціал яких більш негативний, ніж основного металу. Якщо покриття ушкоджується, основний метал буде катодом і він не кородує(рисунок б). Потенціали металів і деполяризаторів залежать від складу розчинів і при їх зміні може змінюватися і характер покриттів. Наприклад у розчині сульфатної кислоти покриття сталі станумом – катодне, а у розчині органічних кислот – анодне. Металеві покриття наносять на основний метал електрохімічне, зануренням у розплавлений метал, металізацією, термодифузією, хімічно.
3.Електрохімічний захист. Його засновано на гальмуванні катодних або анодних реакцій корозійного процесу. Використовують протекторний захист, а також катодну або анодну поляризацію за рахунок зовнішнього джерела струму.
При протекторному захисті до виробу, що захищають, приєднують метал або сплав(так званий протектор), потенціал якого значно негативній, ніж основного металу, наприклад сплави магнію, алюмінію, цинку.
2. Експериментальна частина.
Дослід 1. Утворення оксидної плівки і випробування її корозійної стійкості. Утворення оксидної плівки на поверхні металу спостерігаємо по утворенню кольорів мінливості. Сталеву пластину довжиною 25-30 см і завширшки 3 см ретельно зачищаємо наждачним папером, протираємо розчинником і один кінець пластини затискуємо утримувачем штативу, як це показано на рисунку 9.3.
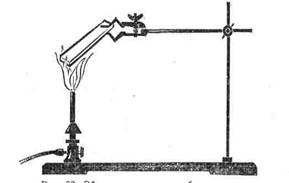
|
Рис. 9.3 – Пристрій для спостерігання утворення кольорів мінливості
Другий кінець пластинки розміщуємо над полум’ям спиртівки, газового пальника або електричною піччю, і нагріваємо. По мірі нагріву пластини з часом на ній з’являються кольори мінливості. Пластину витримуємо у полум’ї впродовж 10-20 хвилин до виникнення синього кольору другого порядку. Після цього пластину знімаємо з вогню і охолоджуємо. До пластину примикаємо лінійку, щоб нульова відмітка починалася з того кінця пластинки, який нагрівався, і через кожний 1 см на довжину 10-15 см, наносимо по краплі 1н розчину Сульфату Купруму(ІІ). При взаємодії з Ферумом перебігає реакція відновлення Купруму:
Fe + CuSO4 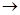 Cu + FeSO4
Cu + FeSO4
внаслідок чого на поверхні металу з’являється пляма Купруму. Час появи кожної плями і колір мінливості занести у лабораторний зошит за формою(таблиця 9.1).
Таблиця 9.1 – Час появи плям Купруму на пластині
| Довжина, см | |||||||||||||
| Час появи плями, сек. | |||||||||||||
| Колір плівки |
За швидкістю появи цієї плями і кольору плівки можна судити о захисних властивостей різних частин оксидної плівки, яка утворилася на металі. Зробити висновки відносно захисних властивостей плівок, що були отримані і порівняти їх з кольором мінливості відповідної частини пластини(а відповідно і товщини плівки).
Дослід 2. Корозія при різноманітній аерації. Частину сталевої пластини зачищаємо наждачним папером, промиваємо водою і висушуємо фільтрувальним папером. На пластину нанесемо краплю розчину, який складається з NaCl, K3[Fe(CN)6] і фенолфталеїну. Спостерігаємо утворення синьої плями по центру краплі і рожевого забарвлення по периферії. При поясненні досліду врахувати, що та частка металу, до якої заважається доступ повітря(у центрі під шаром рідини), є анодом.
Дослід 3. Корозія оцинкованого заліза. U подібну трубку заповнюємо 3% розчином хлориду натрію з додаванням 2-3 крапель фенолфталеїну. У одно коліно занурюємо цинкову пластину, а у інше – сталеву. Пластини з’єднуємо мідним дротом. На якій пластині спостерігається поява малинового забарвлення? Чому? Який метал є катодом, а який анодом?
Дослід 4. Корозія обмідненого заліза. U подібну трубку заповнюємо 3% розчином хлориду натрію з додаванням 2-3 крапель фенолфталеїну. У одно коліно занурюємо мідну пластину, а у інше – сталеву. Пластини з’єднуємо мідним дротом. На якій пластині спостерігається поява малинового забарвлення? Чому? Який метал є катодом, а який анодом? Додайте у коліно, де розташовано сталеву пластину, розчин K3[Fe(CN)6]. Що спостерігається? Чому?
3. Контрольні запитання.
1.У чому принципова відмінність хімічної корозії від електрохімічної?
2.У чому сутність виникнення кольорів мінливості.
3.Яка основна умова утворення захисної плівки у разі газової корозії?
4.Анодний і катодний процеси електрохімічної корозії.
5.Яка умова електрохімічної корозії?
Рекомендована література
1.Лебідь В.І. Фізична хімія. – Харків: Фоліо, 2005. – 478 с.
2.Киреев В.А. Краткий курс физической химии. - М.:Химия,1978.-620с.
3.Кириченко В.І.Загальна хімія: Навч. посіб. – К.: Вища школа., 2005. – 639с.
4.Химия. Рабочая программа и методические указания к выполнению контрольных заданий и лабораторных работ/Ю.А.Пирогов и др. – Харьков.: ХИПИ, 1980. – 162
5.Практикум по физической химии /Под ред. В.В.Буданова и Н.К.Воробьева. -М.: Химия, 1986.-352с.
6.Балезин С.А. Практикум по физической и коллоидной химии/Степан Афанасьевич Балезин – М.: Просвещение, 1972. – 280 с.
Навчальне видання
Методичні вказівки до виконання лабораторних робіт з дисциплін “Фізична хімія” для студентів напрямів підготовки: 6.090801 – “Мікро- та наноелектроніка”, 6.050802 - „Електронні пристрої та системи” денної та заочної форм навчання
Укладач: Олег Іванович Полянчиков
Підписано до друку ___________________2014 р.
Формат_______________Обсяг_________др. арк.
Наклад________прим. Замовлення____________
51918 м. Дніпрдзержинськ,
вул. Дніпробудівська, 2
Date: 2015-05-04; view: 1161; Нарушение авторских прав