
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота №1
|
|
„Визначення теплового ефекту реакції нейтралізації”
Мета роботи: Ознайомитися з теоретичними основами термодинаміки. Визначити тепловий ефект реакції нейтралізації
1.Теоретичні основи: Термодинаміка являє собою наукову дисципліну, яка вивчає, в тому числі, енергетичні ефекти, які супроводжують різні фізичні або хімічні процеси.
Термодинаміка базується на кількох основних законах, з яких найважливішими є перший і другий закони (принципи) термодинаміки.
Перший закон термодинаміки є постулатом і являє частковий випадок закону збереження і перетворення енергії у застосуванні до теплових явищ. Існують різні формулювання першого закону термодинаміки:
1.Всі види енергії переходять один у другий у еквівалентних відношеннях;
2.Внутрішня енергія ізольованої системи залишається незмінною(в ізольованій системі сума усіх видів енергії стала);
3.При взаємоперетвореннях енергія не губиться і не утворюється знов.
4.Не можливо створити вічний двигун першого роду.
Математично перший закон термодинаміки можна записати у формі:
q =  U – A.
U – A.
q – кількість теплоти, яку отримала система. Теплота, що підводиться до системи, вважається позитивною {ендотермічний процес), а що віддається системою — негативною {екзотермічний процес).
А – робота системи. Згідно з рекомендаціями IUРАС позитивною вважається робота, яку виконують зовнішні сили над системою (А > 0). Якщо роботу виконує система, то вона вважається негативною (А < 0). Зауважимо, що у більшості підручників з фізичної хімії до цього часу використовується протилежна система знаків (робота системи А > 0, робота над системою А < 0).
 U – зміна внутрішньої енергії під якою розуміють повну енергію тіла, як сукупність потенціальної і кінетичної енергії усіх часток, які утворюють це тіло.
U – зміна внутрішньої енергії під якою розуміють повну енергію тіла, як сукупність потенціальної і кінетичної енергії усіх часток, які утворюють це тіло.  U - позитивна, якщо внутрішня енергія збільшується і негативна, якщо зменшується.
U - позитивна, якщо внутрішня енергія збільшується і негативна, якщо зменшується.
З цього рівняння випливає, що тепло, яке поглинає система, витрачається на збільшення внутрішньої енергії і виконання системою роботи розширення. Якщо перейти до малих величин, то:
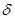 q = dU –
q = dU – 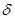 A.
A.
Оскільки всі перетворення відбуваються у еквівалентних кількостях, то для теплоти, внутрішньої енергії і роботи використовується одна одиниця – джоуль (Дж).
Частіш за усе А – це робота системи проти сил зовнішнього тиску, або робота розширення. Для ідеального газу(він розглядається як матеріальні точки, що мають певну масу, тобто власний об’єм молекул нескінченно малий у порівнянні із загальним об’ємом газу) робота елементарного процесу 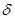 A = -pdV, а для кінцевого процесу:
A = -pdV, а для кінцевого процесу:
А = - 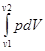 ,
,
де: v1, v2 початковий і кінцевий об’єм системи. Тоді, згідно першого закону:
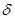 q = dU + pdV.
q = dU + pdV.
В залежності від умов проведення розрізняють такі види процесів(рис. 2.1).
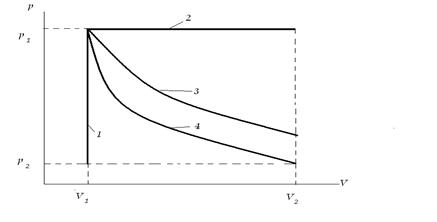
Рисунок 2.1 - Залежність p-V для різних видів процесів. 1- ізохорний(v =const); 2 – ізобарний(p =const); 3 – ізотермічний(T =const); 4 – адіабатичний.
1.Ізохорний процес(v =const), dV =0, і робота розширення А=0, отже:
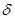 qv = dU, (dU/dT)v=(
qv = dU, (dU/dT)v=(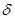 q/dT)v =C
q/dT)v =C 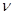 . Звідки dU= C
. Звідки dU= C 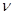 *dT, або
*dT, або  U = C
U = C 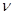 *
*  T.
T.
C 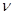 - теплоємність при постійному об’ємі.
- теплоємність при постійному об’ємі.
Таким чином теплота, яка підведена системі при ізохорному процесі, витрачається на збільшення внутрішньої енергії:
qv = U2 – U1 =  U.
U.
2.Ізобарний процес(p =const). Робота розширення 1 моль ідеального газу:
А = - р(V2 – V1) = -p  V. qр =
V. qр =  U – A =
U – A =  U + p
U + p  V = (U2 – U1) +p(V2 – V1)= (U2 + pV2) – (U1 + pV1) = H2 - H1 =
V = (U2 – U1) +p(V2 – V1)= (U2 + pV2) – (U1 + pV1) = H2 - H1 =  H.
H.
Величина H = (U + pV) зветься ентальпією системи,  H -зміна ентальпії системи. Таким чином, теплота, яка підведена системі при ізобарному процесі іде на збільшення ентальпії, якщо єдиним видом роботи є робота розширення.
H -зміна ентальпії системи. Таким чином, теплота, яка підведена системі при ізобарному процесі іде на збільшення ентальпії, якщо єдиним видом роботи є робота розширення.
3.Ізотермічний процес(T =const). При ізотермічному процесі для ідеального газу  U = 0 і q = – A, тобто все підведене тепло повністю перетворюється на роботу розширення(для 1 моль газу, враховуючи pV=RT):
U = 0 і q = – A, тобто все підведене тепло повністю перетворюється на роботу розширення(для 1 моль газу, враховуючи pV=RT):
А = - 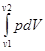 = -
= - 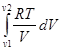 = - RTln
= - RTln 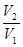 =- RTln
=- RTln 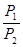 = RTln
= RTln 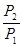 .
.
4.Адіабатичний процес, коли між системою зовнішнім середовищем відсутній обмін тепловою енергією(q = 0). Тоді  U = A, або -
U = A, або -  U = - A; А = C
U = - A; А = C 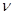 *
*  T = C
T = C 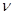 *(T2 – Т1) = (p2V2 – p1V1)/(
*(T2 – Т1) = (p2V2 – p1V1)/(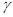 - 1), де
- 1), де 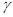 = C
= C 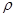 / C
/ C 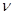 відношення ізобарної і ізохорної теплоємностей, для ідеального газу C
відношення ізобарної і ізохорної теплоємностей, для ідеального газу C 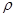 = C
= C 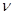 + R. Оскільки тиск і об’єм у вихідному і кінцевому стані пов’язані рівнянням адіабати:
+ R. Оскільки тиск і об’єм у вихідному і кінцевому стані пов’язані рівнянням адіабати: 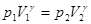 і роботу можна розрахувати за рівнянням:
і роботу можна розрахувати за рівнянням:
А = 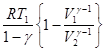 .
.
Теплові ефекти хімічних реакцій. Хімічні реакції супроводжуються виділенням або поглинанням енергії. Найбільша кількість теплоти, яку можливо отримати при перебіганні хімічної реакції зветься тепловим ефектом реакції. Рівняння, яке містить значення теплового ефекту реакції, зветься термохімічним рівнянням, наприклад:
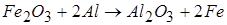 ,
, 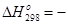 821320 кДж.
821320 кДж.
В термодинаміці теплота q, яка підводиться до системи (реакція перебігає з поглинанням тепла)вважається позитивною(ендотермічний процес) на відміну від термохімії, де ця ж теплота Q вважається негативною. Тому q = -Q. В ізохорному процесі тепловий ефект дорівнює зміні внутрішньої енергії qv =  U, а в ізобарному – зміні ентальпії системи qр =
U, а в ізобарному – зміні ентальпії системи qр =  H.
H.
Для розрахунку теплових ефектів реакцій важливе значення має закон Гесса: Тепловий ефект реакції не залежить від шляху перебігання реакції, а визначається лише вихідним і кінцевим станом системи. В техніці частіше за усе зустрічаються ізобарні процеси, тому, якщо немає вказівок, використовують ізобарні теплові ефекти, для яких qр =  Hр. Із закону Гесса випливає два слідства:
Hр. Із закону Гесса випливає два слідства:
1.Тепловий ефект реакції дорівнює різниці(з урахуванням стехіометричних коефіцієнтів) між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин:
 H =
H = 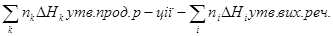
2.Тепловий ефект реакції дорівнює різниці(з урахуванням стехіометричних коефіцієнтів) між сумою теплот згоряння вихідних речовин і сумою теплот згоряння продуктів реакції:
 H =
H = 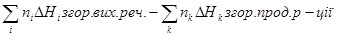
Теплота утворення – тепловий ефект реакції утворення 1 моль складної речовини із елементів(для простих речовин теплота утворення дорівнює 0).
Теплота утворення наведена у таблицях при стандартних умовах -  Н0298: – тиск Р=1.013*105Па(1 атм), Т = 298 К(250С), тому і зміна ентальпії розраховується за стандартних умов. Наприклад, теплота утворення Н2О визначається для реакції: Н2(газ) + 1/2О2(газ) = Н2О(рід).
Н0298: – тиск Р=1.013*105Па(1 атм), Т = 298 К(250С), тому і зміна ентальпії розраховується за стандартних умов. Наприклад, теплота утворення Н2О визначається для реакції: Н2(газ) + 1/2О2(газ) = Н2О(рід).  Н0298 = - 285,83кДж/моль. При розрахунках треба враховувати агрегатний стан речовини, що позначається в термохімічних рівняннях за допомогою індексів. Наприклад, термохімічне рівняння:
Н0298 = - 285,83кДж/моль. При розрахунках треба враховувати агрегатний стан речовини, що позначається в термохімічних рівняннях за допомогою індексів. Наприклад, термохімічне рівняння:
СаО(тв) + Н2О(рід) = Са(ОН)2(тв)  Н = -63,85 кДж/моль.
Н = -63,85 кДж/моль.
Теплота згоряння – тепловий ефект реакції окислення 1 моль речовини в атмосфері чистого Оксигену з утворенням відповідних оксидів.
Тепловий ефект хімічної реакції залежить від температури. Ця залежність підпорядковується рівнянню Кірхгофа: 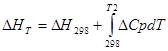 .
. 
2. Експериментальна частина.
Дослід 1. Визначення теплового ефекту реакції нейтралізації. Дослід виконується на найпростішій колориметричній установці яка складається з скляного стакану ємністю 100 мл, розмішеного у термостаті з пінополістиролу, і термометру, розміщеного у кришці з пінополістиролу. Кришка має отвір для внесення кислоти, закритий гумовою пробкою. Робота виконується у наступній послідовності:
1.Налити у сухий стакан за допомогою піпетки 100 мл 0,1н розчину нітратної кислоти
2.Налити у стакан колориметричної системи 100 мл 0,1н розчину гідроксиду натрію.
3.Закрити колориметричну систему кришкою з термометром і впродовж 5-ти хвилин фіксувати температуру через кожну хвилину.
4 Відкрити гумову пробку, через отвір у кришці калориметричної установки через лійку швидко вилити розчин кислоти у розчин лугу, перемішати. Потім знову закрити отвір пробкою.
5.Знову впродовж 5-ти хвилин фіксувати температуру через кожну хвилину.
6.Побудувати графік зміни температури і визначити максимальне значення різниці температур  Т після Т2 і до Т1 змішування розчинів.
Т після Т2 і до Т1 змішування розчинів.
7.Розібрати установку, вилити розчин, помити і висушити калориметричний стакан.
8. Прийняв питому густину розчину після нейтралізації 1г/см3 і його теплоємність С рівною теплоємності води, розрахувати кількість теплоти, яка виділилася при даній реакції за формулою:
Q= C*m*(T2 – T1).
9.По отриманим даним розрахувати теплоту реакції нейтралізації і визначити помилку, враховуючи, що теплота реакції нейтралізації сильної кислоти сильною основою дорівнює 57,1 кДж.
Контрольні питання і завдання
1.Дати формулювання першого закону термодинаміки.
2.Як розрізняють види процесів в залежності від умов їх проведення?
3.Яка величина зветься ентальпією системи?
4.Що називається тепловим ефектом хімічної реакції, теплотою утворення, теплотою згоряння?
5.Яке рівняння зветься термохімічним?
6.Які процеси звуться екзотермічними, а які ендотермічними?
7.Закон Гесса і наслідки з нього.
8.Як тепловий ефект хімічної реакції залежить від температури?
9.Визначити тепловий ефект наступних реакцій:
3Fe2O3 + CO  2Fe3O4 + CO2,
2Fe3O4 + CO2,
CaO + 3C = CaC2 + CO,
Fe2O3 + 2Al = Al2O3 + 2Fe.
Date: 2015-05-04; view: 774; Нарушение авторских прав