
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 8. Мета роботи: Ознайомитися з теоретичними основами електролізу, законом Фарадею, дослідити електроліз розчинів сульфату натрію з інертними електродами і
|
|
„ Електроліз ”
Мета роботи: Ознайомитися з теоретичними основами електролізу, законом Фарадею, дослідити електроліз розчинів сульфату натрію з інертними електродами і розчину сульфату купруму з активним мідним анодом.
1. Теоретичні основи: Якщо до системи, яка складається з двох електродів, занурених у розчин(розплав) електроліту підвести електричний струм від зовнішнього джерела струму, то відбудеться процес електролізу – сукупність реакцій окислення – відновлення, які перебігають на електродах. При електролізі хімічні реакції відбуваються за рахунок використання енергії електричного струму.
В розчині при проходженні струму позитивно заряджені іони рухаються у напрямку до негативно зарядженого електроду і на ньому відновлюються(катод), а негативно заряджені іони рухаються у напрямку позитивно зарядженого електроду і на ньому окислюються(анод). При електролізі катод – негативно заряджений електрод(-), він підключається до негативного полюсу зовнішнього джерела струму, а анод – позитивно заряджений електрод, він підключається до позитивного полюсу зовнішнього джерела струму. В електролізі також можуть брати участь іони водню і гідроксилу, які утворюються при дисоціації води. Таким чином у катода можуть відновлюватися позитивно заряджені іони електроліту і водню, а у анода окислюватися іони електроліту і гідроксил іони. Який іон буде розряджатися раніше залежить від його положення у ряду напруги, концентрації іонів і матеріалу електроду. Так на катоді в першу чергу перебігають процеси, які характеризуються найбільш позитивним потенціалом, а на аноді – процеси, які характеризуються найбільш негативним потенціалом. Катіони металів з негативним значенням стандартних електродних потенціалів(від літію до алюмінію) на катоді не відновлюються. В цьому випадку на катоді відновлюються молекули води:
2H2O + 2e = H2 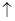 + 2OH-.
+ 2OH-.
Катіони металу з електродним потенціалом від титану до гідрогену, відновлюються одночасно з молекулами води, а з електродним потенціалом більш позитивним ніж у гідрогену – відновлюються на катоді:
Сu2+ + 2e = Cu.
Аніони без кисневмісних кислот(крім F-) окислюються на аноді, а кисневмісних не окислюються, а окислюються молекули води:
2H2O – 4e = O2 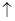 + 4H+.
+ 4H+.
При електролізі розчинів луг на аноді виділяється кисень:
4OH- -4e = O2 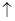 + 2H2O.
+ 2H2O.
Матеріал електроду може бути інертним(графіт, платина) і активним(метал, який окислюється у процесі електролізу). Якщо анод активний, відбувається анодне розчинення металу, наприклад купруму:
Cu0 – 2e = Cu2+.
Послідовність розряду іонів на електродах не завжди відповідає їх електродним потенціалам. 1.Електроліз розчину Na2S04 з нерозчиненим анодом. У розчині знаходяться іони Na+, SО42-, Н+, ОН-. В нейтральному середовищі(рН=7) потенціал водневого електроду (25°С) дорівнює:
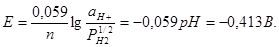
Оскільки цей потенціал більш позитивний ніж потенціал натрію(-2,7В), то на катоді буде виділятися гідроген, а на аноді - оксиген. Реакції:
на катоді: 2Н2О + 2е 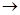 Н2 + 2ОН-,
Н2 + 2ОН-,
на аноді: Н2О - 2е 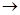 О2 + 2Н+,
О2 + 2Н+,
сумарною реакцією є реакція розкладення води: Н2О 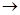 Н2 + О2.
Н2 + О2.
2.Електроліз розчину NiSО4 з нікелевим анодом. Потенціал ніколу більш позитивний, ніж гідрогену, тому на катоді відбувається відновлення металу і його виділення: Ni2+ + 2е 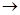 Ni. На аноді відбувається окислення ніколу Ni - 2е
Ni. На аноді відбувається окислення ніколу Ni - 2е 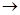 Ni +, тому що потенціал цього процесу менше потенціалу окислення води і сульфат іону.
Ni +, тому що потенціал цього процесу менше потенціалу окислення води і сульфат іону.
Проходження електричного струму через електрохімічну систему пов’язане з хімічними перетвореннями, тому між кількістю електрики, що пройшла, та кількістю речовини, що прореагувала, існує певний зв’язок, який встановлений законами Фарадея.
Перший закон Фарадея. Вагові кількості речовин, перетворених при електролізі, пропорційні кількості електрики, що пройшла через електроліт, і не залежать від інших факторів.
Другий закон Фарадея. Рівні кількості електрики виділяють при електролізі із різних хімічних сполук еквівалентні кількості речовини. Таким чином для виділення 1 моль-екв. речовини необхідно 96500Кл(26,8Агод) електрики, або:
m= 
При електролізі не вся кількість електрики перетворюється на виділення потрібного елементу. Частка загальної кількості електрики, яка витрачається на виділення однієї із речовин, зветься виходом за струмом(%) цієї речовини:
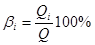
де: Qi – кількість електрики, яка витрачена на перетворення і-тої речовини;
Q – загальна кількість електрики.
2. Експериментальна частина.
Дослід 1. Електроліз водного розчину сульфату натрію з графітовими інертними електродами. В якості електролізеру використовується U- подібна скляна трубка в якій міститься 0,5 н розчин сульфату натрію. Для спостереження за процесом електролізу у кожне коліно треба додати 3-5 крапель індикатору – алізаринового червоного. В кожне коліно треба вставити графітові електроди і приєднати їх до джерела сталого струму. Після приготування електролізеру ввімкнути джерело струму і встановити напругу приблизно 10 В.
За деякий час спостерігати виділення газоподібних продуктів реакції і зміну забарвлення розчину у при катодному і при анодному просторах. Через 4-6 хвилин вимкніть електролізер. Поясніть причину різного забарвлення розчину і наведіть рівняння реакцій на катоді і аноді, враховуючи, що на катоді відновлюються, а на аноді – окислюються молекули води.
Дослід 2. Електроліз водного розчину сульфату Купруму з мідним активним електродом. В якості електролізеру використовується хімічний стакан на 500 мл з тримачем електродів. Заповніть стакан розчином Купруму сульфату. Поверхню мідних електродів зачистить наждачним папером. Один з електродів зважте на технохімічних вагах з точністю 0,01г і приєднайте його до негативного полюсу джерела струму(катоду). Мідний анод приєднайте до позитивного полюсу.Електроди встановіть на відстані 2-3 см один від одного і включить струм. Встановіть величину струму 0,5 А і включить секундомір. У процесі електролізу спостерігайте за сталістю струму і підтримуйте його постійним. Через одну годину відключить джерело живлення, катод промийте водою і після сушки визначте його масу. Експериментальні дані занесіть у таблицю 8.1 спостережень.
Теоретичне значення збільшення маси визначте за формулою:
m=  ,
,
а вихід за струмом за формулою:
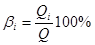
Зробіть висновки щодо реакцій, які перебігають на нерозчинених і розчинених електродах.
Таблиця 8.1 - Таблиця спостережень
| Маса катоду до елект ролізу, г | Сила струму, а | Час елект ролізу, с | Маса катоду після елект ролізу, г | Зміна маси катоду, г | Кіль кість елект рики Кл | Теоре тична маса міді, г | Вихід за струмом |
Контрольні запитання.
1.Що таке електроліз?
2.У якому напрямі при електролізі пересуваються позитивно і негативно заряджені іони?
3.При електролізі анод – негативно чи позитивно заряджений електрод, а катод – позитивно чи негативно заряджений електрод?
4.У чому різниця електролізу розчинів електроліту від електролізу розплавів?
5.Від чого залежить послідовність відновлювання позитивно заряджених іонів на катоді і окислення негативно заряджених іонів на аноді?
6.Сформулюйте закони електролізу.
7.Яка кількість речовини відновлюється або окислюється при проходженні через електролізер 96500 Кл електрики?
8.Що таке вихід за струмом?
Date: 2015-05-04; view: 802; Нарушение авторских прав