
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота №5
|
|
„ Іонні реакції у розчинах електролітів ”
Мета роботи: Освоїти сутність реакцій у розчинах електролітів і придбати навички складання іонних реакцій.
1. Теоретичні основи: Згідно теорії електролітичної дисоціації реакції у розчинах електролітів(в яких немає зміни зарядів іонів) відбуваються не між молекулами, а між іонами, на які дисоціюють молекули електролітів. Напрям цих реакцій визначається рівновагою, яка встановлюється у розчині між іонами.
У розчинах слабких електролітів, наприклад оцтової кислоти встановлюється рівновага:
CH3COOH 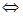 CH3COO- + H+,
CH3COO- + H+,
що характеризується константою рівноваги, яка у цьому випадку зветься константою електролітичної дисоціації, або константою іонізації і має вигляд:
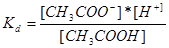 .
.
Константа рівноваги пов’язана зі ступенем дисоціації законом розведення Освальда:
.
Чим більше константа дисоціації, тим більше ступінь дисоціації, тим сильніше електроліт, тим більше його спроможність розпадатися на іони. Чим константа дисоціації менше, тим міцніша сполука, тим менше вона розпадається на іони.
Для важкорозчинних сполук, при наявності осаду. між осадом і розчином встановлюється рівновага:
AgCI(тв) 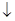 «Ag+ + CI-.
«Ag+ + CI-.
В рівноважному стані розчин містить максимальну при даних умовах (температура, розчинник) кількість розчиненої речовини – він насичений. Для насиченого розчину малорозчинного електроліту закон діючих мас має вигляд:
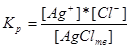 .
.
Враховуючи, що при наявності твердою фази її концентрація не змінюється, а залишається сталою, то:
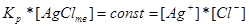
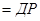 .
.
У стані рівноваги у насиченому розчині малорозчинного електроліту добуток концентрації іонів є константою і зветься добутком розчинності. Для насиченого розчину хлориду аргентуму іонний добуток дорівнює добутку розчинності:
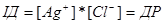 =1,78*10-10.
=1,78*10-10.
В насиченому розчині неможливо ні розчинення осаду ні утворення осаду. Якщо в розчині міститься менша концентрація розчиненої речовини ніж добуток розчинності, то такий розчин ненасичений. Для нього:
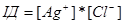 < ДР.
< ДР.
В ненасиченому розчині можливо розчинення осаду.
Якщо концентрація розчиненої речовини у розчині більше, ніж добуток розчинності, то такий розчин зветься пересиченим і з нього буде утворюватися осад. Для пересиченого розчину:
 > ДР.
> ДР.
Таким чином осадження важкорозчинної сполуки можливо лише тоді, коли іонний добуток перевищує добуток розчинності.
В загальному вигляді для електроліту типу KtaAnb вираз для добутку розчинності має вигляд:
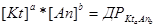 .
.
Таким чином добуток розчинності – це константа рівноваги для система розчин-осад.
Всі реакції іонного обміну характеризуються зменшенням значення енергії Гіббса і перебігають при значенні константи рівноваги більше одиниці. Наприклад: розглянемо можливість взаємодії між СаСО3 і НСl:
СаСО3 + 2НСl 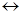 CaCl2 + H2СO3.
CaCl2 + H2СO3.
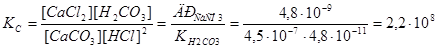 .
.
Константа рівноваги більше 1, реакція перебігає у прямому напрямку.
Якщо записати цю реакцію у іонному вигляді:
СаCO3 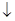 + 2H+ + 2Cl-
+ 2H+ + 2Cl-  Ca2+ 2Cl- + H2CO3.
Ca2+ 2Cl- + H2CO3.
Реакції у розчинах електролітів, таким чином, перебігають у напрямку утворення слабких електролітів, важкорозчинних або летких сполук і комплексних іонів. Для зображення реакцій, які відбуваються між електролітами, користуються іонними рівняннями, в яких важкорозчинні, леткі, слабкі електроліти і комплексні іони записуються у вигляді молекул(комплексних іонів), а розчинні сильні електроліти – у вигляді іонів. Данні, стосовно сили електролітів і їх розчинності, наведені у довідковій літературі. Нижче наведені деякі приклади іонних реакцій
1. Реакція нейтралізації.
Реакція в молекулярній формі: 2NaOH + H2SO4 = Na2SO4 + 2H2O.
Іонне рівняння реакції: 2Na+ + 2OH- + 2H+ +SO2-4 = 2Na+ + SO2-4 + 2H2O.
Після скорочення однакових іонів у лівій і правій частинах: 2OH- + 2H+ = 2H2O.
Після скорочення коефіцієнтів: OH- + H+ = H2O.
Таким чином реакція нейтралізації зводиться до утворення слабкого електроліту – води.
2. Реакція взаємодії сильних електролітів з утворенням осаду.
Реакція в молекулярній формі: BaCl2 + Na2SO4 = BaSO4  + 2NaCl.
+ 2NaCl.
Іонне рівняння реакції: Ba2+ + SO42- = BaSO4  .
.
3. Реакція взаємодії слабкого електроліту з сильним з утворенням осаду.
Реакція в молекулярній формі: H2S + Pb(NO3)2 = PbS  + 2HNO3.
+ 2HNO3.
Іонне рівняння реакції: H2S + Pb2+ = PbS 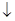 + 2H+.
+ 2H+.
4.Взаємодія осаду з кислотою:
а)Реакція в молекулярній формі: MnS 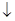 + 2HCl
+ 2HCl 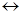 H2S + MnCl2.
H2S + MnCl2.
Іонне рівняння реакції: MnS 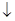 + 2H+
+ 2H+ 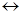 H2S + Mn2+.
H2S + Mn2+.
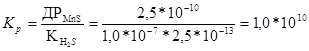
Реакція можлива.
б)Реакція в молекулярній формі: Ag2S 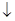 + 2HCl
+ 2HCl 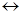 2AgCl
2AgCl 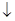 +H2S.
+H2S.
Іонне рівняння реакції: Ag2S 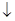 + 2H++ 2Cl-
+ 2H++ 2Cl- 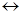 2AgCl
2AgCl 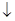 +H2S.
+H2S.
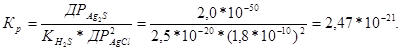
Константа рівноваги менше 1, реакція у прямому напрямку неможлива.
До іонообмінних реакцій відносять і реакції гідролізу. Гідроліз солі - взаємодія іонів розчиненої солі з іонами, які утворюються при дисоціації води. Гідроліз супроводжується зміною рН розчину, що пов’язане зі зміщенням рівноваги процесу дисоціації води внаслідок утворення мало дисоційованих або малорозчинних сполук.
Перебігання реакції гідролізу і рН розчину залежать від різноманітних факторів і в першу чергу від природи катіону і аніону, що утворюють сіль.
Сіль, утворена катіоном одно кислотної сильної основи і аніоном одноосновної слабкої кислоти, наприклад:
КСN + H2O 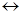 KOH + HCN,
KOH + HCN,
СN- + H2O 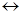 OH- + HCN.
OH- + HCN.
Кажуть, що така сіль гідролізується по аніону, середовище розчину набуває лужну реакцію (рН>7).
Сіль, утворена катіоном одно кислотної слабкої основи і аніоном одноосновної сильної кислоти, наприклад:
NH4Cl + H2O 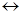 NH4OH + HCl,
NH4OH + HCl,
NH4+ + H2O 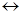 NH4OH + H+.
NH4OH + H+.
Кажуть, що така сіль гідролізується по катіону, середовище розчину набуває кислу реакцію (рН<7).
Солі слабких кислот і слабких основ гідролізуються у більшій мірі, оскільки тут можуть утворюватися одночасно усі можливі продукти гідролізу.
CH3COONH4 + H2O ↔ CH3COOH + NH4OH,
рН середовища залежить від співвідношення констант дисоціації кислоти і основи: якщо сильніша кислота – рН < 7, якщо сильніша основа – рН > 7 (утворюється або слабо кисле, або слабо лужне середовище).
2. Експериментальна частина.
Дослід 1. Взаємодія сильного електроліту з сильним електролітом без утворення малорозчинних, газоподібних сполук і слабких електролітів. Розмістить у пробірці 0,1 н розчин КNO3 і додайте 0,1н розчин NaCl. Поясніть відсутність утворення осаду і виділення газоподібних продуктів реакції.
Дослід 2. Реакція утворення слабкого електроліту – води(реакція нейтралізації). Внесить у пробірку 5 крапель 0,1н розчину нітратної кислоти. За допомогою універсального індикаторного паперу визначить приблизне значення рН розчину кислоти. Додайте у пробірку 6 крапель 0,1н розчину натрію гідроксиду. Визначить приблизне значення рН отриманого розчину за допомогою універсального індикаторного паперу. Як змінилося значення рН отриманого розчину? З чим це пов’язане? Який слабкий електроліт утворився при взаємодії сильної кислоти з сильною основою?
Дослід 3. Реакція взаємодії сильних електролітів з утворенням осаду. Внесіть в пробірку по 2-3 краплини розчинів солей ВаСl2 і К2СrО4. Відмітьте колір отриманого осаду. Чому ці солі взаємодіють між собою?
ВаСl2 + К2СrО4 →
Напишіть рівняння реакції в молекулярній та іонно-молекулярній формах.
Дослід 4. Реакція взаємодії сильних електролітів з утворенням газоподібної сполуки. У чистий сухий тигель помість 1-2 краплі розчину солі амоніаку (наприклад, NH4Cl), додайте 2-3 краплі NaOH або KOH, накрийте предметним склом із прикріпленим вологим рожевим лакмусовим папером. Тигель злегка нагрійте(якщо концентрація іонів NH4+ незначна), не допускаючи розбризкування рідини:
NH4Cl + NaOH 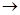 NaCl + NH3 + H2O,
NaCl + NH3 + H2O,
NH4+ + OH- 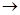 NH3 + H2O.
NH3 + H2O.
Спостерігайте зміну кольору вологого індикаторного лакмусового паперу з рожевого у синій:
NH3 + H2O 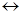 NH4OH.
NH4OH.
Амоніак, що утворився, можна спостерігати і за запахом(Обережно! Не направляти отвір пробірки на обличчя!).
Дослід 5. Реакція розчинення осаду з утворенням комплексної сполуки
До 4-5 крапель розчину солі купруму додайте 1-2 краплі розчину NH4OH до появи зеленуватого осаду (CuOH)2SO4:
2CuSO4 + 2NH4OH 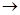 (CuOH)2SO4
(CuOH)2SO4 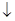 + (NH4)2SO4.
+ (NH4)2SO4.
Додайте надлишок аміаку (5-6 крапель 2 н розчини NH4OH або 1-2 краплі концентрованого розчину аміаку), до повного розчинення осаду і появи інтенсивно синього кольору:
(CuOH)2SO4 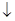 + 6NH4OH + (NH4)2SO4
+ 6NH4OH + (NH4)2SO4 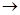 2[Cu(NH3)4]SO4 + 8H2O
2[Cu(NH3)4]SO4 + 8H2O
Сумарне рівняння має вигляд:
CuSO4 + 4NH4OH 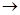 [Cu(NH3)4]SO4 + 4H2O.
[Cu(NH3)4]SO4 + 4H2O.
Чому надлишок лугу приводить до розчинення осаду?
Дослід 6. Визначення характеру середовища при гідролізі. Нанесіть по краплі розчинів NaCl, FeCl3, Na2CO3 на смугу універсального індикаторного паперу. Зробіть висновок щодо характеру середовища у цих розчинах. В якому випадку спостерігається зміна рН середовища від нейтрального, а в якому ні. Напишіть реакції гідролізу для тих солей що гідролізуються.
Date: 2015-05-04; view: 840; Нарушение авторских прав