
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 6. “окисно-відновні реакції”
|
|
“Окисно-відновні реакції”
Мета роботи: Ознайомитися з окисно-відновними реакціями, основними окисниками і відновниками, навчитися визначати напрямок і повноту перебігання окисно-відновних реакцій.
1. Теоретичні основи: Окислювально-відновними звуть реакції що перебігають зі зміною ступеню окислення реагуючих речовин і супроводжуються переходом електронів від одних елементів до інших. Окисником зветься речовина у склад якої входить атом елемента що приєднує електрони (ступінь окислення зменшується). У процесі окисно-відновної реакції окисник відновлюється. Відновник – атом елемента, що віддає електрони. Відновник у процесі окисно-відновної реакції окислюється (ступень окислення збільшується). Таким чином для перебігання окисно-відновної реакції необхідна участь як мінімум двох окислювальне відновних систем, які звуться окисно-відновними парами (редокс парами). Редокс пара – окислена Ох і відновлена Red форми одного і того ж елементу, наприклад Ох / Red. Окислена форма є окисником, а відновлена – відновником. У загальному вигляді окисно-відновну реакцію можливо визначити схемою:
Ox1 + Red2 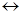 Red1 + Ox2,
Red1 + Ox2,
де: Ox1/Red1, Ox2/ Red2 - відповідно редокс пари першого і другого елементів.
Кожна редокс пара має більшу чи меншу окислювальну спроможність, яка характеризується окисно-відновним потенціалом. Розрізняють стандартний і реальний редокс потенціали.
Стандартним потенціалом даної редокс пари Е0 вважають ЕРС гальванічного елементу, складеного з досліджуваного електроду при концентраціях окисною і відновної форм 1 моль/л, температурі 250С і стандартного водневого електроду, потенціал якого прийнято за 0:
Е02Н+/Н2 = 0.
Реальний потенціал залежить від деяких факторів. Ця залежність підпорядковується рівнянню Нернста:
 ,
,
де Е0 – стандартний редокс потенціал;
R – універсальна газова стала:
T - абсолютна температура;
n – число прийнятих чи відданих електронів;
F – стала Фарадея;
[ Ox ] – активність (концентрація у розведених розчинах) окисної форми;
[ Red ] – активність (концентрація розведених розчинів) відновленої форми;
a,b – стехіометричні коефіцієнти.
Порівнюючи стандартні потенціали редокс пар можливо вирішити питання о принциповій можливості перебігання окисно-відновної реакції і її напрямку.
Зі збільшенням значення Е0 збільшується сила окислювача (окисленої форми) і зменшується сила відновника (відновленої форми). Тому для взятих редокс пар більш сильний окисник (окислена форма редокс пари з більш позитивним потенціалом) буде відбирати електрони у більш сильного відновника (відновлена форма редокс пари з більш негативним потенціалом) і при цьому будуть утворюватися більш слабкі окисник і відновник.
Принципова можливість перебігання окисно-відновної реакції буде при різних окисно-відновних потенціалах редокс пар. Якщо окисно-відновні потенціали однакові, реакція неможлива.
Наприклад, для двох редокс пар:
Cl2/2Cl- E0 = + 1,36B
Fe3+/Fe2+ E0 = + 0,77B
окисником буде Cl2, а відновником Fe2+ і напрямок реакції буде наступним:
Cl2 + 2Fe2+ = 2Cl- + 2Fe3, але не
2Fe3 + 2Cl- = 2Fe2+ + Cl2.
Чим більше різниця окисно-відновних потенціалів, тим більш повно перебігає реакція у сторону утворення продуктів реакції. При різниці у 0,4В і більше можна вважати, що реакція незворотна.
Таблиця 6.1 - Стандартні електродні потенціали у водних розчинах деяких редокс пар
| Редокс пара | Рівняння процесу (іонно-електронна полу реакція) | Е0, В |
| S2O82-/2SO42- | S2O82- + 2e = 2SO42- | + 2,010 |
| H2O2/ H2O | H2O2 + 2H+ + 2e = 2H2O | +1,770 |
| MnO4-/Mn2+ | MnO4-+8 H++5e=Mn2++4H2O | +1,510 |
| Cl2/2Cl- | Cl2 + 2e = 2Cl- | +1,359 |
| Cr2O72-/2Cr3+ | Cr2O72-+14H++6e=2Cr3++7H2O | +1,333 |
| NO3-/NO | NO3- +4H++3e = NO + 2H2O | +0,960 |
| O2/H2O | O2 + 4H+ + 4e = 2 H2O | +1,229 |
| O2/H2O(10-7M) | O2 + 4H+ + 4e = 2 H2O | +0,815 |
| Ag+/Ag | Ag+ + 1e = Ag | +0,799 |
| MnO4-/MnO2 | MnO4-+2H2O+3e = MnO2+4OH- | +0,600 |
| MnO4-/MnO42- | MnO4- + 1e = MnO42- | +0,560 |
| Fe3+/Fe2+ | Fe3+ +1e = Fe2+ | +0,771 |
| Fe3+/Fe | Fe3+ +3e = Fe | -0,036 |
| Fe2+/Fe | Fe2+ +2e = Fe | -0,440 |
| Sn4+/Sn2+ | Sn4+ + 2e = Sn2+ | +0,150 |
| Сu2+/Cu | Сu2+ + 2e = Cu | +0,337 |
| Сu2+/Cu+ | Сu2+ + 1e = Cu+ | +0,159 |
Сu2+/CuI 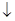
| Сu2+ + I- + 1e = CuI | +0,860 |
| I2/2I- | I2 + 2e = 2I- | +0,536 |
| S4O62- /S2O32- | S4O62- + 2e = 2S2O32- | +0.090 |
| S/S2- | S + 2e = S2- | -0,480 |
| SO42-/SO32- | SO42-+H2O+2e=SO32-+2OH- | -0,930 |
До типових окисників відносяться: прості речовини, атоми яких мають високу електронегативність(галогени, оксиген), катіони і аніони, які містять атоми з високим ступенем окислення(Fe3+, Pb4+, MnO4-, CrO4-). До типових відновників відносяться прості речовини з малою ЕН, наприклад метали, водень, карбон; аніони, атоми яких знаходяться у низькій ступені окислення – Cl-, I-, S-2. Стандартні електродні потенціали у водних розчинах деяких окисників і відновників наведені у таблиці 6.1.
2. Експериментальна частина.
Дослід 1. Витіснення більш активним металом менш активного з його солі. У одну пробірку внесіть 6-7 крапель розчину CuSO4, а у другу стільки ж розчину Na2SO4. У обидві пробірки занурить по однієї гранулі Zn. Які зміни Ви спостерігаєте у пробірках? Поясніть Ваші спостереження за величинами стандартних окисно-відновних потенціалів і напишіть рівняння реакцій. Стандартні окисно-відновні потенціали для металів складають: Na+/Na E0 = -2,714B, Zn2+/Zn E0 =-0,763B, Сu2+/Cu E0 =+0,337B.
Дослід 2. Взаємодія алюмінію з фосфатною кислотою. Внесіть у пробірку 8-10 крапель фосфатної кислоти і трохи порошку алюмінію. Злегка підігрійте розчин(Обережно! Не направляйте пробірку у лице.). Спостерігайте утвореня бульбашок газу за схемою реакції:
Al + H3PO4 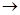 AlPO4 + H2
AlPO4 + H2 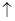 .
.
Поясніть Ваші спостереження за величинами стандартних окисно-відновних потенціалів і напишіть рівняння реакцій.
Дослід 3. Взаємодія Na2SO3 з вільним йодом. Внесіть у пробірку 2-3 краплі Na2SO3 і додайте одну краплю спиртового розчину йоду. Зверніть увагу на зміну забарвлення розчину йоду з коричневого до безбарвного, що свідчить про відновлення вільного йоду до іонів йоду за схемою реакції:
Na2SO3 + I2 + H2O 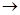 Na2SO4 + HJ.
Na2SO4 + HJ.
Поясніть можливість перебігання реакції у наведеному напрямку за величинами стандартних окисно-відновних потенціалів(таблиця 1) і напишіть рівняння реакцій.
Дослід 4. Окислення іонів J- іонами Fe3 +. У пробірку помістить 2-3 краплі розчину солі FeСl3 і одну краплю розчину KJ. Вміст пробірки розбавити дистильованою водою до слабо-жовтого кольору і внести 1-2 краплі розчину крохмалю.
FeСl3 + KJ →
Про що свідчить наявність темно-синього забарвлення? Поясніть можливість перебігання реакції у наведеному напрямку за величинами стандартних окисно-відновних потенціалів(таблиця 1) і напишіть рівняння окисно-відновної реакції.
Дослід 5. Окислення іонів Fe2+ H2O2 (Гідроген пероксидом). Внести в пробірку 3-4 краплі свіжо приготовленого розчину FeSO4 (Феруму (ІІ) сульфату) і додати до нього 1-2 краплі 2н розчину NaOH (Натрій гідроксиду).
FeSO4 + NaOH →
Відмітити колір осаду.
До отриманого розчину додати 1-2 краплі розчину H2O2 (Гідроген пероксиду).
Fe(OH)2 + H2O2 →
Про що свідчить наявність іржавого забарвлення? Поясніть можливість перебігання реакції у наведеному напрямку за величинами стандартних окисно-відновних потенціалів(таблиця 1) і напишіть рівняння окисно-відновної реакції.
Дослід 6. Окислення іонів Cr3+ H2O2 (Гідроген пероксидом). У пробірку внесіть 1-2 краплі розчину солі Cr2 (SO4)3 (Хром (ІІІ) сульфату) і додати по краплях 2н розчин 2н розчину NaOH (Натрію гідроксиду) доти, поки первинний осад, що випав, Cr(OH)3, цілком не розчиниться в результаті утворення хроміту Na3 [Cr(OH)6].
Cr2(SO4)3 + NaOHнадл→
Відзначте колір розчину.
До отриманого розчину хроміту Na3 [Cr(OH)6] додайте 1-2 краплі розчину H2O2 (Гідроген пероксиду).
Na3 [Cr(OH)6] + H2O2 →
Відзначте колір розчину. Про що свідчить перехід зеленого кольору в жовтий? Поясніть можливість перебігання реакції у наведеному напрямку за величинами стандартних окисно-відновних потенціалів(таблиця 1) і напишіть рівняння окисно-відновної реакції.
Контрольні питання і завдання
1.Які реакції звуться окисно-відновними?
2.Яка речовина, що приймає участь у окисно-відновній реакції зветься окисником, а яка відновником?
3.Що таке окисно-відновна пара?
4.Як впливає величина окисно-відновного потенціалу редокс пари на силу її окисної і відновної форм?
5.Які з приведених нижче рівнянь реакцій є окисно-відновними? Вкажіть в них окисник і відновник. Відповідь мотивуйте.
2NaOH + H2SO4 = Na2SO4 + 2H2O
2NaBr + 2H2SO4 = Br2 + Na2SO4 + SO2 + 2H2O
PBr3 + 3H2О = 3HBr + H3PO3
CaО + H2O = Cа(OH)2
Mn(OH)2 + 2HCl = MnCl2 + 2H2O
MnО2 + 4HCl = MnCl2 + Cl2 + 2H2O
2. Які з зазначених речовин можуть виявляти тільки окисні властивості?
HClО4, KClО3, NaBr, Fe
CaCl2, FeCl2, Cl2, PH3
TіО2, Na2S, S, Cu
3. Підібрати коефіцієнти в наступних окисно-відновних реакціях і вказати окисники і відновники:
H2S + HNO3 = H2SO4 + NO + H2O
H2S + Cl2 + H2O = H2SO4 + HCl
Zn + H2SO4(конц.) = H2S + ZnSO4 + H2O
FeCl2 + KNO3 + HCl = FeCl3 + NO + KCl + H2O
Mn2O7 + Cr2O3 = CrО3 + MnО
Mn(NO3)2+ PbО2 + HNO3 = HMnО4 + Pb(NO3)2 + H2O
KClО3 = KClО4 + KCl.
Date: 2015-05-04; view: 1400; Нарушение авторских прав