
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 7. „вимірювання електрорушійної сили гальванічного елементу”
|
|
„ Вимірювання електрорушійної сили гальванічного елементу ”
Мета роботи: Ознайомитися з теоретичними основами роботи гальванічного елементу, виміряти електрорушійну силу (ЕРС) гальванічного елементу і визначити електродні потенціали окремих електродів, з яких складається цей елемент.
1. Теоретичні основи: Процеси взаємного перетворення електричної енергії у хімічну і навпаки звуть електрохімічними процесами. Їх можливо розділити на дві групи:
1.Процеси перетворення хімічної енергії у електричну(гальванічні елементи)
2. Процеси перетворення електричної енергії у хімічну(електроліз).
Процеси як першої, так і другої груп засновані на окисно-відновних реакціях, які супроводжуються переносом електронів від одних елементів до інших і зміною ступеню окислення відповідних елементів.
1.1. Гальванічні елементи. Пристрій для отримання електричної енергії за рахунок електрохімічної реакції зветься електрохімічним(гальванічним) елементом, або хімічним джерелом струму(ХДС). Найпростіший елемент складається з двох металевих електродів(провідників першого роду) занурених у розчин електроліту(провідник другого роду). Прикладом такого елементу є елемент Даніеля-Якобі(рисунок 7.1). Він складається з двох електродів – цинкового і мідного, які занурені у розчини своїх солей. Для запобігання прямого контакту окисника і відновника, розчини розділені пористою мембраною, або трубкою, яка заповнена електролітом – електролітичний ключ.
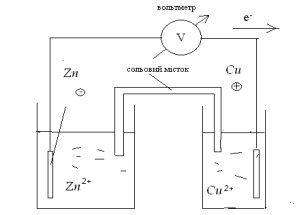
Рисунок 7.1 – Схема гальванічного елементу.
При роботі такого елементу на електродах перебігають реакції:
На аноді – реакція окислення(анодний процес): Zn – 2e = Zn2+
На катоді – реакція відновлення(катодний процес): Cu2+ + 2e = Cu
Сумарне рівняння реакції, що перебігає: Zn + Cu2+ 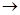 Cu + Zn2+.
Cu + Zn2+.
Зазвичай гальванічний елемент зображують схематично:
- Zn I Zn2+ II Cu2+ I Cu +
Однією рискою зображують межу розділу провідник першого роду – провідник другого роду, а подвійною – межу розділу між провідниками другого роду(якщо вони з’єднуються електролітичним містком). Електрорушійна сила гальванічного елементу вважається позитивною(ЕРС за фізичним змістом є позитивною величиною, оскільки вона відповідає певному довільному процесу, що дає позитивну роботу), якщо при роботі елемента електрони у зовнішньому колі проходять від електрода, записаного зліва до електрода, записаного праворуч.
Найважливішою характеристикою електрохімічного елементу є його електрорушійна сила(ЕРС) Е – різниця потенціалів розімкнутого елементу, тобто різниця потенціалів між кінцями провідників першого роду з одного і того ж матеріалу, приєднаних до електродів гальванічного елементу. ЕРС являє собою різницю потенціалів в умовах рівноваги, коли в елементі не проходить електричний струм. Якщо замкнути електроди, то у колі буде проходити електричний струм, і різниця потенціалів являє собою напругу електрохімічного елементу, відмінну від ЕРС на величину падіння напруги на внутрішньому опорі елементу.
Тоді для гальванічного елементу можна записати:
Е = Ек - Еа.
Рівняння для потенціалу окремого електроду:
Е =  ,
,
звичайно називають рівнянням Нернста для електродного потенціалу.
Виміряти або розрахувати потенціал окремого електроду неможливо, але можливо визначити ЕРС гальванічного елементу одним з електродів якого є той що досліджується, а іншим відповідний електрод порівняння. ЕРС такого елемента визначають як електродний потенціал. Електродом порівняння зазвичай використовують стандартний водневий електрод, потенціал якого при 250С, активності іонів Гідрогену 1 моль/л і тиску Гідрогену 1,013 *105 Па(1атм) прийнятий рівним Е0 = 0 В(рис. 7.2). Він являє собою платинову пластину, яка покрита платиновою черню, і яка насичується очищеним і осушеним воднем.

Рис. 7.2 - Стандартний водневий електрод
Якщо активність іонів у розчині, що досліджується, дорівнює одиниці, то ЕРС такого кола дорівнює стандартному потенціалу цього електроду. Таким чином стандартний електродний потенціал вимірюють по відношенню до електродних процесів:
Men+ + ne + Me0, E0Me
2H+ + 2e =H2, E02H/H2 = 0
Практично використовувати стандартний водневий електрод в якості електроду порівняння не зручно, тому найбільш важливим у практиці є хлорид срібний електрод порівняння. Потенціал хлорид срібного електроду постійний і дорівнює +0,22 В відповідно до стандартного водневого електроду.
1.2. Вимірювання ЕРС гальванічного елементу. Визначення електрорушійної сили гальванічного елементу може бути здійснено з достатньою точністю, або компенсаційним методом або за допомогою високоомних перетворювачів. Це пов'язано з тим, що через розчин не повинен текти електричний струм, щоб не змінювалася концентрація аналізуємої речовини внаслідок електролізу.
У лабораторній роботі для вимірювання ЕРС використовується іономір ЕВ – 74, який застосовується для виміру напруги і має шкалу градуйовану в мілівольтах.
2. Обладнання і реактиви:
1.Іономір ЕВ - 74.
2.Мідний і цинковий електроди з комірками для розчинів електроліту.
3.Розчин CuSO4 1М.
4. 1М розчин ZnSO4.
5.Хлор срібний електрод порівняння.
6.Насичений розчин KCl.
6.Стакан на 50 мл для насиченого розчину KCl.
3. Порядок виконання роботи. Лабораторна робота виконується у наступній послідовності:
3.1.Виміряти електродні потенціали мідного і цинкового електродів. Для цього:
3.1.1.Заповнити комірки розчинами CuSO4 і ZnSO4 слідкуючи за тим, щоб бокова трубка посудини також була заповнена розчином. Потім занурити у кожну комірку металеву пластинку з відповідного металу.
3.1.2.Обидва електроди боковими трубками занурити у стакан із насиченим розчином 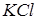 .
.
3.1.3.В цей стакан також занурити хлор срібний насичений електрод порівняння, потенціал якого при 25 С дорівнює 0,22В.
3.1.4.Для визначення електродного потенціалу міді скласти коло:
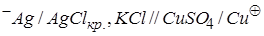 і виміряти його е.р.с.
і виміряти його е.р.с.
3.1.5.Для визначення електродного потенціалу цинку скласти коло:
 і виміряти його е.р.с.
і виміряти його е.р.с.
3.1.6.Експериментальні електродні потенціали відповідних електродів розрахувати за рівнянням Е = Ек - Еа. і занести у таблицю.
3.1.7.Теоретичні значення електродних потенціалів міді і цинку розрахувати за рівнянням Нернста Е =  , використовуючи замість активності іонів їх концентрацію, і занести у таблицю.
, використовуючи замість активності іонів їх концентрацію, і занести у таблицю.
3.2.Скласти гальванічний елемент з двох півелементів (електродів) мідного і цинкового. Отримане електрохімічне коло відповідає схемі:
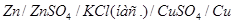 .
.
Провести вимірювання е.р.с. досліджуваного елементу і записати його значення у таблицю 7.1.
Таблиця 7.1 - Таблиця спостережень
| Схема гальванічного елементу | Концент рація розчинів | ЕРС, мВ | Електродний потенціал | |
| Експерімен тальний | Теорет ичний | |||
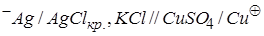
| ||||

| ||||
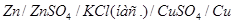
|
4. Скласти звіт про роботу, який повинен мати:
1. Теоретичні основи роботи гальванічного елементу.
2. Схему для вимірювання електропровідності розчинів.
3. Результати визначення ЕРС відповідних гальванічних елементів.
4. Таблицю спостережень.
5. Розрахунки експериментальних і теоретичних значень електродних потенціалів і ЕРС гальванічного елементу.
Контрольні питання
1.Що таке стандартний електродний потенціал?
2.По відношенню до яких електродних процесів вимірюють стандартний електродний потенціал?
3.Від яких факторів залежить електродний потенціал?
4.Рівняння Нернста для електродного потенціалу.
5.ЕРС гальванічного елементу. Рівняння для розрахунку.
Date: 2015-05-04; view: 1067; Нарушение авторских прав