
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 2. “ визначення питомої теплоємності металу і його молярної маси атомів”
|
|
“ Визначення питомої теплоємності металу і його молярної маси атомів”
Мета роботи:експериментально визначити молярну теплоємність атомів металу і його молярну масу атомів.
1. Теоретичні основи: Перший закон термодинаміки є постулатом і являє частковий випадок закону збереження і перетворення енергії у застосуванні до теплових явищ. Існують різні формулювання першого закону термодинаміки:
1.Всі види енергії переходять один у другий у еквівалентних відношеннях;
2.Внутрішня енергія ізольованої системи залишається незмінною(в ізольованій системі сума усіх видів енергії стала);
3.При взаємоперетвореннях енергія не губиться і не утворюється знов.
4.Не можливо створити вічний двигун першого роду.
Математично перший закон термодинаміки можна записати у формі:
q =  U – A.
U – A.
q – кількість теплоти, яку отримала система.
А – робота системи.
 U – зміна внутрішньої енергії системи.
U – зміна внутрішньої енергії системи.
З цього рівняння випливає, що тепло, яке поглинає система, витрачається на збільшення внутрішньої енергії і виконання системою роботи розширення. Якщо перейти до малих величин, то:
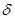 q = dU –
q = dU – 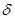 A.
A.
Оскільки всі перетворення відбуваються у еквівалентних кількостях, то для теплоти, внутрішньої енергії і роботи використовується одна одиниця – джоуль (Дж).
Частіш за усе А – це робота системи проти сил зовнішнього тиску, або робота розширення. Для ідеального газу(він розглядається як матеріальні точки, що мають певну масу, тобто власний об’єм молекул нескінченно малий у порівнянні із загальним об’ємом газу) робота елементарного процесу 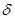 A = -pdV, а для кінцевого процесу:
A = -pdV, а для кінцевого процесу:
А = - 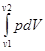 ,
,
де: v1, v2 початковий і кінцевий об’єм системи. Тоді, згідно першого закону:
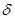 q = dU + pdV.
q = dU + pdV.
В залежності від умов проведення розрізняють такі види процесів(рис. 6.1).
1.Ізохорний процес(v =const), dV =0, і робота розширення А=0.
2.Ізобарний процес(p =const
3.Ізотермічний процес(T =const). При ізотермічному процесі для ідеального газу  U = 0 і q = – A, тобто все підведене тепло повністю перетворюється на роботу розширення(для 1 моль газу, враховуючи pV=RT):
U = 0 і q = – A, тобто все підведене тепло повністю перетворюється на роботу розширення(для 1 моль газу, враховуючи pV=RT):
А = - 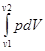 = -
= - 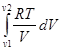 = - RTln
= - RTln 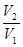 =- RTln
=- RTln 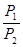 = RTln
= RTln 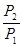 .
.
4.Адіабатичний процес, коли між системою зовнішнім середовищем відсутній обмін тепловою енергією(q = 0). Тоді  U = A, або -
U = A, або -  U = - A; А = C
U = - A; А = C 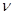 *
*  T = C
T = C 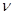 *(T2 – Т1) = (p2V2 – p1V1)/(
*(T2 – Т1) = (p2V2 – p1V1)/(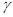 - 1), де
- 1), де 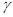 = C
= C 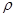 /C
/C 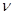 відношення ізобарної і ізохорної теплоємностей, для ідеального газу C
відношення ізобарної і ізохорної теплоємностей, для ідеального газу C 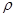 = C
= C 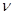 +R. Оскільки тиск і об’єм у вихідному і кінцевому стані пов’язані рівнянням адіабати:
+R. Оскільки тиск і об’єм у вихідному і кінцевому стані пов’язані рівнянням адіабати: 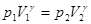 і роботу можна розрахувати за рівнянням:
і роботу можна розрахувати за рівнянням:
А = 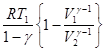 .
.
Теплоємність. Загальна теплоємність системи — це кількість теплоти, яка потрібна для підвищення температури системи на один градус. Оскільки вона є величиною екстенсивною, то більш зручно користуватися теплоємністю, віднесеною до одиниці кількості речовини. В залежності від цього розрізняють питому (на 1 г чи 1 кг маси речовини) та мольну (на 1 моль) теплоємності(Дж/моль*К). Їх величини залежать також від умов нагрівання ізохорна — СV (при V = const) та ізобарна СP (р = const). Теплоємність залежить від природи речовини, а також від температури, тому розрізняють середню теплоємність C у заданому інтервалі температур (від Т1 до Т2) та істинну теплоємність С при заданій температурі Т. Середня теплоємність: С =  q/(T2 – T1), а істинна: С =
q/(T2 – T1), а істинна: С = 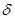 q/
q/ 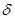 T. Середня теплоємність наближається до істинної при зменшенні температурного інтервалу, коли (Т2 — Т1)
T. Середня теплоємність наближається до істинної при зменшенні температурного інтервалу, коли (Т2 — Т1) 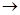 0.
0.
Кількість теплоти, яка потрібна для нагрівання системи від Т1 до Т2:
Q = C*M*(T2 – T1) =M* 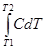 .
.
Середня і істинна теплоємність пов’язані співвідношенням:
C = 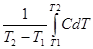 ; C =
; C = 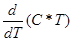 .
.
В залежності від агрегатного стану теплоємності речовин розраховуються по різному. Для одноатомних ідеальних газів теплоємність визначається тільки поступальним рухом їх молекул. Із молекулярно-кінетичної теорії газів випливає, що мольна теплоємність одноатомного газу дорівнює С V= 3/2 R = 12,471 Дж/моль*К і не залежить від температури. Для газів із двохатомними молекулами теорія дає СV = 5/2R = 20,96, з триатомними — СV = 3R = 24,94 Дж/моль*К, але в дійсності для багатьох газів спостерігаються значні відхилення від цих значень та суттєві температурні зміни. Для переходу від CP до CV існує залежність: CP = CV +R. Вона виконується тільки для молярних або атомних теплоємностей.
Для розрахунку теплоємності рідин кінетична теорія газів взагалі не може бути застосована. Для них теплоємність залежить від їх хімічного складу, структури, температури. Для більшості рідин теплоємність зростає при підвищенні температури, для ртуті — зменшується, а для води — проходить через мінімум. Різниця між CP і CV для рідин може бути більшою або меншою за R і залежить від коефіцієнта об'ємного розширення а = V-1. Наприклад, для рідкого гелію при 140 К ця різниця становить 89,3 Дж/моль-К, а для води при 273 К — лише 0,08 Дж/моль*К.
Для простих одноатомних твердих речовин у кристалічному стані атомна ізобарна теплоємність при кімнатних температурах дорівнює CP =26,3-26,8 Дж/моль*К(закон Дюлонга і Пті). Мольна теплоємність складних речовин в кристалічному стані дорівнює сумі атомних теплоємностей елементів, які входять в їх склад і є величиною адитивною. Для твердих речовин CP і CV відрізняються несуттєво (CV 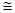 3R =24,94).
3R =24,94).
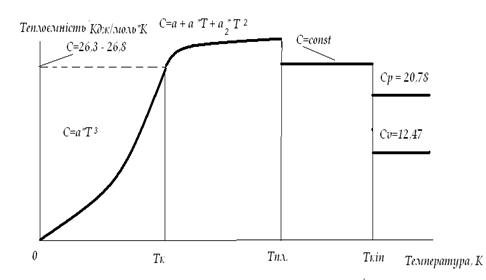
Рисунок 6.2 - Графік залежності теплоємності від температури.
Теплоємність суттєво залежить від температури. На рисунку 6.2. наведена залежність теплоємності від температури для більшості металів. При наближенні температури до абсолютного 0 теплоємність наближається до 0. В інтервалі від 0 до кімнатної температури С = а*Т3, де: а - к-т пропорційності. В інтервалі від кімнатної температури до температури плавлення теплоємність може бути розрахована за рівнянням С = а0 + а1Т + а2Т, де: а0, а1, а2 відповідні коефіцієнти. Теплоємності металів у рідкому стані в більшості випадків дещо менше ніж у твердому стані і не залежать від температури. Більшість металів у газоподібному стані є одноатомними, тому їх теплоємності визначаються як: CV = 12,47 Дж/моль*К, CP = 20,78 Дж/моль*К.
Атомна теплоємність металів – СА дорівнює добутку питомої теплоємності – С на молярну масу атомів металу - МА: СА = С*МА. Згідно правила Дюлонга і Пті атомна теплоємність для більшості твердих речовин приблизно дорівнює CP =26,3-26,8(26,6) Дж/моль*К: СА = С*МА = 26,6 Дж/моль*К. Таким чином, вимірявши питому теплоємність простої речовини можна визначити приблизне значення молярної маси атомів простої речовини(металу): МА = 26,6/С г/моль. Питому теплоємність металу вимірюють з теплового балансу кількості теплоти, відданої металом, і кількості теплоти, отриманої водою, питома теплоємність якої відома.
2. Експериментальна частина. Дослід проводиться в спрощеному калориметрі, який складається із стакану на 250 мл в якому розміщується вода. Стакан ізольований пінополістиролом і закривається піно полістирольною кришкою, в якій мається отвір для термометру з діленням по 0,10С.
Визначення питомої теплоємності виконується в наступній послідовності.
1.Візьміть окремий стакан об’ємом 500 мл заповніть його 250 мл води і нагрійте її до кипіння(1000С).
2.Візьміть шматок металу(за вказівкою викладача) масою приблизно 50 г і зважте на технохімічних вагах з точністю 0,1 г.
3.Перевяжить метал ниткою і занурите у киплячу воду приблизно на 15-20 хвилин.
4.Стакан калориметру зважте на технохімічних вагах з точністю 0,1 г, налите в нього 100-150 мл води і знов зважте на технохімічних вагах з точністю 0,1 г.
5.Стакан з водою розташуйте в калориметрі, закрийте кришкою з термометром і виміряйте початкову температуру води.
6.Відкрийте кришку калориметру і швидко перенесіть шматок металу з киплячої води в стакан калориметру.
7.Прикройте калориметр кришкою і обережно перемішуючи термометром воду, визначте максимальну кінцеву температуру, до якої нагріється вода. Отримані експериментальні дані запишіть у зошит за наступною формою. Результати досліду:
1.Маса шматка металу – mM =,г.
2.Маса порожнього стакану калориметру – mC = г,
3.Маса стакану калориметру з водою – mC+B =,г.
4.Температура металу – 1000С.
5.Початкова температура води у стакані калориметру – t1 =,С.
6.Максимальна кінцева температура води у стакані калориметру – t2 =,С.
7.Теплоємність води – СВ =, Дж/моль*К.
8.Теплоємність скла – СС =, Дж/моль*К.
8.Розрахунки:
1.Маса води: mB = mC+B - mC.
2.Кількість теплоти, яку витрачає метал: Q = mM*C(100 – t2).
3.Кількість теплота, яка витрачається на нагрів води і стакану калориметру:
Q = mB*CB*(t2-t1) + mC*CC*(t2-t1) = (mB*CB + mC*CC) *(t2-t1).
4.Тепловий баланс: mM*C(100 – t2) = (mB*CB + mC*CC) *(t2-t1).
5.Визначення питомої теплоємності металу:
C = [(mB*CB + mC*CC) *(t2-t1)]/ mM*(100 – t2).
6.За знайденою питомою теплоємністю металу за правилом Дюлонга і Пті, визначаємо молярну масу атомів металу: МА = 26,6/С.
7.Знаючи, який метал використовувався, визначте відносну помилку досліду:
g={|MТ – MА|/MТ}*100%.
Контрольні питання і завдання
1.Формулювання і математичний вираз першого закону термодинаміки.
2.Теплоємність: питома, мольна, ізохорна, ізобарна.
3.Розрахунки теплоємності для газів, рідин, твердих речовин.
4.Залежність теплоємності від температури.
Date: 2015-05-04; view: 1383; Нарушение авторских прав