
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 3
|
|
„ Хімічна кінетика. Хімічна рівновага ”
Мета роботи: Ознайомитися з впливом різноманітних факторів на швидкість хімічних реакцій і засвоїти сутність хімічної рівноваги і вплив зовнішніх умов на стан рівноваги.
1. Теоретичні основи: Хімічна кінетика вивчає швидкість і механізми хімічних реакцій, а також залежність швидкості реакції від різноманітних факторів.
Розрізняють середню(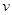 ) і істину(
) і істину(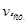 ) швидкість реакції. Середня швидкість – зміна концентрації реагуючих речовин у заданому інтервалі часу
) швидкість реакції. Середня швидкість – зміна концентрації реагуючих речовин у заданому інтервалі часу 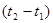 :
:
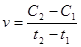 .
.
С2 і С1 –відповідно концентрації речовин в моменти 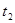 і
і 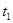 .
.
Істина швидкість – швидкість в даний момент часу як перша похідна концентрації С у часі:
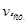 =
= 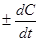 .
.
Знак + відноситься до речовини що утворюється, а знак – до вихідної речовини.
Залежність швидкості хімічної реакції від концентрації реагуючих речовин виражається законом діючих мас: швидкість реакції прямо пропорційна добутку молярних концентрацій реагуючих речовин, які взяті у ступенях їх стехіометричних коефіцієнтів. Для реакції аА+вВ+сС:
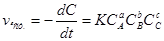 .
.
Коефіцієнт пропорційності К зветься константою швидкості реакції. Її фізичний сенс - це швидкість реакції при концентраціях реагуючих речовин 1 моль/л. Константа швидкості залежить від природи реагуючих речовин і температури.
Показники ступенів а,b,с звуться порядком реакції за речовинами (частковий порядок), а їх сумарне значення 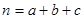 зветься загальним порядком реакції. Порядок реакції може бути нульовим, цілочисельним і дробовим.
зветься загальним порядком реакції. Порядок реакції може бути нульовим, цілочисельним і дробовим.
Молекулярність реакції – число молекул, що беруть участь в елементарному акті хімічної взаємодії. Відповідно розрізняють одно-, бі- і тримолекулярні реакції.
Швидкість хімічної реакції в значній мірі залежить від температури. Для приблизного оцінювання впливу температури на швидкість хімічної реакції у незначному температурному інтервалі і при порівняно низьких температурах можна використовувати емпіричне правило Вант-Гоффа: при збільшені температури на 10К швидкість реакції збільшується у 2-4 рази:
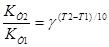 , або:
, або: 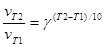 ,
,
KT1 і КT2 – константи швидкості реакції при температурах Т1 і Т2;
vT1 і vT2 – швидкості реакції при температурах Т1 і Т2;
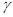 =2-4 - температурний коефіцієнт швидкості реакції.
=2-4 - температурний коефіцієнт швидкості реакції.
Більш точно залежність константи швидкості реакції від температури передається рівнянням Арреніуса:
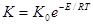 .
.
У цьому рівнянні:
К - константа швидкості;
К0 - предекспоненційний множник;
Е - енергія активації – кількість енергії, яка необхідна щоб перевести один моль молекул, що знаходяться у нормальному стані, в особливо активну, реакційно здатну форму, Дж/моль.
Більшість реакцій одночасно перебігають у прямому і зворотному напрямках, такі реакції звуться оборотними. Для реакції:
aA + bB 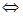 cC + dD,
cC + dD,
швидкість прямої реакції 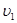 :
:
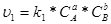 ,
,
швидкість зворотної реакція:

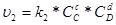 .
.
Нарешті наступає момент коли швидкості зрівняються – настає хімічна рівновага. При рівновазі ні пряма ні зворотна реакції не припиняються, вони ідуть з однаковою швидкістю – скільки вихідних продуктів витрачається за прямою реакцією, стільки їх утворюється за зворотною реакцією. Таким чином хімічна рівновага носить рухомий, динамічний характер, хоча склад системи не змінюється – концентрації речовин становляться «рівноважними» отже:
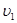 =
= 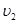 ;
; 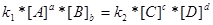 ,
,
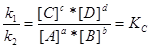 .
.
При хімічній рівновазі при постійних температурі і тиску відношення добутку рівноважних концентрацій продуктів реакції к добутку рівноважних концентрацій вихідних речовин є величина стала яка зветься константою рівноваги реакції КС . При цьому рівноважні концентрації беруться у ступенях, що відповідають їх стехіометричним коефіцієнтам.
Як видно з рівняння для константи рівноваги, її чисельне значення характеризує напрямок і повноту перебігання реакції. Якщо КС > 1 реакція пряма; КС <1 реакція зворотна. Чим більше константа рівноваги, тим більш повно перетворюються вихідні речовини. Зміна зовнішніх умов (зміна температури, тиску, введення в систему додаткової кількості одного з компонентів або його виведення з реакційної суміші, введення інертних речовин тощо) призводить до порушення сталої рівноваги і переходу системи до нового стану рівноваги. Якісно вплив зовнішніх умов на положення рівноваги оцінюється за допомогою принципу рухомої рівноваги (принципу Ле- Шательє):
При зовнішньому впливі на систему, яка знаходиться в стані рівноваги, в системі відбуваються зміни, спрямовані проти цих зовнішніх впливів. Наприклад, додавання якої небудь речовини, яка приймає участь у реакції, призводить до зміщення рівноваги у бік тієї реакції, за якою ця речовина витрачається(це витікає з рівняння для константи рівноваги). Рівноважні концентрації реагуючих речовин можуть змінюватися, але константа рівноваги за даної температури залишається незмінною.
2. Експериментальна частина.
Дослід 1. Вплив концентрації реагуючих речовин на швидкість хімічної реакції. Класичним прикладом гомогенної реакції є взаємодія між розчинами тіосульфату натрію Na2S2O3 і фосфатною кислотою H3PO4, яка перебігає за рівняннями:
3Na2S2O3 +2H3PO4 = 3H2S2O3 + 2Na3PO4,
H2S2O3 = SO2 + S 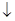 + H2O.
+ H2O.
Сульфур, що є продуктом реакції, утворює колоїдний розчин, який фіксується за появою ледь помітного помутніння. Час появи помутніння залежить від швидкості реакції і вимірюється секундоміром від початку змішування вихідних речовин. Дослід виконується в наступній послідовності.
В дві пробірки додайте по 6 мл розчинів натрію тіосульфату Na2S2O3 і фосфатної кислоти H3PO4. Розчини злийте(фосфатну кислоту додайте до розчину тіосульфату натрію), включить секундомір і бовтніть пробірку декілька разів. Виміряйте час до появи ледь помітного помутніння і занесіть у таблицю 3.1.
Таблиця 3.1- Час появи помутніння в залежності від концентрації Na2S2O3.
| № | Об’єм, мл | Об’єм розчину H3PO4, мл | Час до появи помутніння, сек. | Умовна швидкість реакції, 100/t. | |
| Na2S2O3 | H2O | ||||
Наступні досліди виконують з меншими концентраціями Na2S2O3. Для цього в пробірки налийте відповідно 4, 3 і 2 мл Na2S2O3 і додайте в цю ж пробірку воду до загального об’єму 6 мл(таблиця 1). Кількість розчину H3PO4 залиште незмінною – 6 мл. Час появи помутніння для 2, 3 і 4 досліду також занесіть у таблицю. За отриманими даними побудуйте графік залежності умовної швидкості реакції 100/t(вісь ординат) від концентрації(вісь абсцис). Який вигляд має ця залежність? Зробить висновки щодо впливу концентрації на швидкість реакції.
Дослід 2. Вплив температури на швидкість хімічної реакції. Цей дослід також виконується на прикладі попередньої реакції. Візьміть дві пробірки. В одну налийте 2 мл Na2S2O3 і 4 мл води, у другу 6 мл розчину H3PO4. Розмістить пробірки з термометром у стакан з водою кімнатної температури, заждіть деякий час для зрівняння температури розчинів(5-7 хвилин), злийте розчини, включить секундомір і бовтніть декілька разів пробірку. Запишіть у таблицю 2 час появи помутніння. Зробить цей дослід з іншою температурою, більшою на 10-20 К, додаючи у стакан гарячу воду. Також отриманий результат запишіть у таблицю 3.2.
Таблиця 3.2- Час появи помутніння в залежності від температури розчинів.
| № | Об’єм, мл | Об’єм розчину H3PO4, мл | Температура 0С | Час до появи помутніння, сек. | Умовна швидкість реакції, 1/t. | |
| Na2S2O3 | H2O | |||||
Визначте температурний коефіцієнт швидкості даної реакції. Зробить висновки щодо впливу температури на швидкість реакції.
Дослід 3. Вплив зміни концентрації реагуючих речовин на зсув хімічної рівноваги. Вплив зміни концентрації реагуючих речовин на хімічну рівновагу зручно дослідити на прикладі реакції:
FеСl3 + 3КСNS ↔ Fе(СNS)3 + 3КСl.
Червоне забарвлення Fе(СNS)3 (Ферум (ІІІ) тіоціонат) дозволяє слідкувати за зсувом хімічної рівноваги при зміні концентрації реагуючих речовин: чим більша концентрація вихідних речовин тим інтенсивніший червоний колір розчину, але чим більше концентрація продуктів реакції, тим менша інтенсивність забарвлення.
Помістіть в склянку 10 мл 0,1н розчину FеСl3 і додайте 10 мл 0,1н розчину КСNS. Розлийте отриманий розчин у чотири пробірки, по 5 мл у кожну. Першу пробірку залиште контрольною. У другу внесіть 4-5 краплин концентрованого розчину FеСl3, в третю – стільки ж концентрованого розчину КСNS, в четверту – трохи кристалічного КСl. Четверту пробірку треба струснути для прискорення розчинення солі.
Порівняйте забарвлення розчинів у другій, третій і четвертій пробірках із забарвленням в першій – контрольній – пробірці і поясніть (на основі принципу Ле-Шательє) характер зсуву хімічної рівноваги, пов’язаного зі зміною концентрації вихідних речовин і продуктів реакції. Напишіть вираз для константи рівноваги. Можливо чи ні стверджувати, що зміна концентрації реагуючих речовин приводить до зміни значення константи рівноваги?
Контрольні питання і завдання
1. Напишіть математичний вираз для швидкості прямої та зворотної реакцій:
а) N2 + О2 ↔ 2NО; б) СО + Сl2 ↔ СОСl2; в) N2 + 3Н2 ↔ 2NН3.
2. Який фізичний сенс константи швидкості?
3. Напишіть вираз константи рівноваги для таких оборотних процесів:
а) 2NО2 ↔ N2О4; б) 2NО2 ↔ 2NО + О2; в) 3Н2 + N2 ↔ 2 NН3;
г) 2SО2 + О2 ↔ 2SО3; д) С(кр.) + Н2О(пара) ↔ Н2 + СО.
5. В якому напрямку зміщується рівновага наступних реакцій при підвищенні температури:
а) 2SО2 + О2 ↔2SО3 + 47 ккал; б) Н2 + Вr2 ↔ 2НВr + 17,5 ккал;
в) N2 + О2 ↔ 2NО – 43,2 ккал; г) 2N2 + О2 ↔2N2О – 30 ккал.
Date: 2015-05-04; view: 769; Нарушение авторских прав