
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 4. „електролітична дисоціація
|
|
„ Електролітична дисоціація.
Електропровідність розчину електроліту ”
Мета роботи: Ознайомитися з теоретичними основами електролітичної дисоціації, дослідити вплив природи розчиненої речовини, концентрації розчину на електропровідність електроліту.
1. Теоретичні основи: За своїми властивостями у розчинах всі речовини поділяють на електроліти і не електроліти. Електроліти розпадаються у розчинах на позитивно і негативно заряджені частки – катіони і аніони. Теорія електролітичної дисоціації була розроблена Арреніусом і розвинута на основі гідратної теорії розчинів. У сучасному порозумінні - електролітична дисоціація це процес розпаду електроліту на іони під дією полярних молекул розчинника. При цьому утворюються нестійкі сполуки іонів з молекулами розчинника – сольвати. Якщо розчинник вода – то гідрати.
В залежності від природи електроліти розпадаються на іони по різному. Спроможність електроліту розпадатися на іони характеризує ступінь електролітичної дисоціації 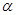 - відношення числа молекул електроліту, які розпалися на іони
- відношення числа молекул електроліту, які розпалися на іони 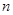 , до загальної кількості молекул електроліту
, до загальної кількості молекул електроліту 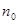 :
:
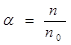 .
.
За ступенем дисоціації розрізняють:
Сильні електроліти 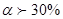 - HCl, HNO3, NaOH, KOH, майже усі солі.
- HCl, HNO3, NaOH, KOH, майже усі солі.
Середньої сили 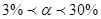 - HNO2, H2SO3, H3PO4.
- HNO2, H2SO3, H3PO4.
Слабкі 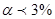 - HCN, H2S, CH3COOH, NH4OH та інші.
- HCN, H2S, CH3COOH, NH4OH та інші.
У розчинах слабкі і сильні електроліти ведуть себе по різному. В водних розчинах сильних електролітів існують тільки гідратовані іони – катіони і аніони і відсутні молекули. У водних розчинах слабких електролітів розчинена речовина може існувати як у вигляді гідратованих іонів, так і у вигляді не дисоційованих молекул.
Частіш за усе в хімії мають справу з кислотами, лугами, солями, які є електролітами. Електроліти у розчинах і розплавах проводять електричний струм, не електроліти електричний струм не проводять. До не електролітів відносяться цукор, спирти, ефіри, інші речовини.
Електроліти відносять до провідників другого роду – речовин, у яких електропровідність забезпечують іони на які розпадається електроліт в розплавленому чи розчиненому стані.
Провідність провідників характеризується електропровідністю – L, яка оборотна опору:
L = 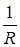 .
.
Опір провіднику R прямо пропорційний його довжині l і зворотно пропорційний перетику S:
R = 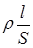 ,
,
де: 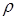 - питомий опір, характеризує опір провіднику з одиничними розмірами: довжиною і перетином, які дорівнюють одиниці. Величина, яка зворотна питомому опору:
- питомий опір, характеризує опір провіднику з одиничними розмірами: довжиною і перетином, які дорівнюють одиниці. Величина, яка зворотна питомому опору:
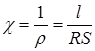 ,
,
зветься питомою електропровідністю 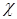 (каппа). Вона має основну одиницю виміру См/м, і може визначатися у См/см (См – сименс = ом-1).
(каппа). Вона має основну одиницю виміру См/м, і може визначатися у См/см (См – сименс = ом-1).
У разі розчинів електролітів величина S – площа електродів, між якими знаходиться розчин; l - відстань між ними, тобто 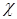 - це електропровідність 1м3 розчину, який міститься між плоскими паралельними електродами, що знаходяться на відстані 1 м один від одного.
- це електропровідність 1м3 розчину, який міститься між плоскими паралельними електродами, що знаходяться на відстані 1 м один від одного.
Електропровідність розчинів залежить від природи електроліту, його концентрації, температури.
Питома електропровідність для сильних і більшості слабких електролітів залежить від концентрації розчину. При цьому з ростом концентрації питома електропровідність досягає максимуму, а потім зменшується (рисунок 4.1).
χ, См/см
Рисунок 4.1 - Залежність питомої електропровідності від концентрації
Питома електропровідність розчинів електролітів залежить від температури. З ростом температури на один кельвін питома електропровідність зростає приблизно на 2-2,5 %. Це пояснюється зниженням густини розчинів, зменшенням гідратації іонів, а для слабких електролітів збільшенням їх ступеню дисоціації.
2. Експериментальна частина.
Дослід 1. Випробування електропровідності розчинів електролітів і не електролітів. Під керівництвом викладача виміряти електропровідність розчинів різних речовин на стенді, який складається зі стакану для розчину; електродів; електричної лампочки. Електроди занурені у стакан з розчином і з’єднані з джерелом струму, в електричне коло послідовно підключена електрична лампочка(рис. 4.2). УВАГА!!! Для живлення використовується мережа 220 В, тому треба бути уважними і не торкатися дротів і розчину руками! Підготовку к досліду виконувати при виключеному пристрої!
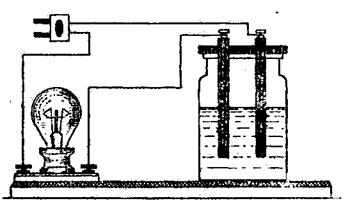
|
Рисунок 4.2 – Прилад для дослідження електропровідності розчинів
Електропровідність приблизно можливо оцінювати за напругою на електродах. Чим нижче електропровідність, тим напруга буде більше.
Випробувати електропровідність розчинів: дистильованої води, цукру, солі.
Спочатку заповнити стакан дистильованою водою, занурити електроди, включити пристрій у мережу (Поки електроди не занурені у розчин, пристрій категорично забороняється підключати у мережу), виміряти напругу і дослідити, загоряється лампочка, або ні. Результат занести у лабораторний журнал.
Виключити пристрій з мережі і всипати у воду трохи цукру. Включити пристрій. Проводить чи ні розчин цукру електричний струм?
Виключити пристрій з мережі. Вилити розчин цукру, промити електроди дистильованою водою і всипати в дистильовану воду трохи кухонної солі. Включити пристрій. Проводить чи ні розчин солі електричний струм?
Результати досліду занести у таблицю 4.1.
Таблиця 4.1 – Електропровідність розчинів електролітів і не електролітів
| Найменування розчину | Яскравість лампочки | Напруга | Електропровідність |
| Дистильована вода | |||
| Розчин цукру | |||
| Розчин солі |
Дослід 2. Вплив на електропровідність природи електроліту. Електропровідність залежить від рухомості іонів у розчині. Дослідити електропровідність розчинів різних електролітів: нітратної кислоти, оцтової кислоти, гідроксиду натрію, натрію хлориду однієї концентрації. При переході від одного розчину до іншого ретельно промити електроди і стакан дистильованою водою. Увага!!! Промивання стакану і електродів обов’язково виконувати при виключеному пристрої. Зробить висновки щодо яскравості лампочки і електропровідності електролітів. Результати дослідів занести у таблицю 4.2.
Таблиця 4.2 – Вплив природи електроліту на електропровідність
| Найменування розчину | Яскравість лампочки | Напруга | 1/U, В-1 | Електропровідність |
| 0,1 н HNO3 | ||||
| 0,1 н CH3COOH | ||||
| 0,1 н NaOH | ||||
| 0,1 н NaCl |
Дослід 3. Вплив на електропровідність концентрації електроліту. Електропровідність залежить від концентрації електроліту. Дослідіть електропровідність розчинів натрію хлориду різної концентрації. Дослід проводити в наступній послідовності. Дослідити електропровідність 0,1 н розчину NaCl. Потім розвести цей розчин у 2 рази відмірюючи воду і розчин NaCl мірним циліндром і виміряти електропровідність розведеного розчину. Увага!!! Розведення розчину, промивання стакану і електродів обов’язково виконувати при виключеному пристрої. Зробить висновки щодо яскравості лампочки і електропровідності розчинів різної концентрації. Результати дослідів занести у таблицю 4.3.
Таблиця 4.3 – Вплив концентрації електроліту на електропровідність
| Найменування розчину | Яскравість лампочки | Напруга | 1/U, В-1 | Електропровідність |
| 0,1 н NaCl | ||||
| 0,05 н NaCl | ||||
| 0,025 н NaCl | ||||
| 0,0125 н NaCl | ||||
| 0,00625 н NaCl |
3. Контрольні запитання.
1.У чому сутність електролітичної дисоціації?
2.У чому сутність проходження електричного струму скрізь розчин електроліту?
3.Що таке ступень електролітичної дисоціації?
4.Як електропровідність електролітів залежить від його концентрації?
5.Як електропровідність електролітів залежить від температури?
Date: 2015-05-04; view: 989; Нарушение авторских прав