
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химические свойства концентрированной серной кислоты
|
|
Оказывается, при взаимодействии некоторых кислот с металлами в роли окислителя могут выступать не ионы H+, а анионы кислотного остатка. К таким кислотам относится концентрированная серная кислота. Она может окислять (растворять) даже металлы, расположенные в ряду активности за водородом.
Массовая доля H2SO4 в концентрированной серной кислоте составляет 98 %. То есть вода в концентрированной серной кислоте практически отсутствует. Поэтому ионные уравнения для реакций с участием концентрированной серной кислоты не записывают.
Еще раз напомним, что особыми свойствами обладает только концентрированная серная кислота. Разбавленная серная кислота обладает всеми свойствами обычных кислот. Например, разбавленная H2SO4 реагирует только с металлами, расположенными в ряду активности перед водородом:

Как видно, в реакциях с разбавленной серной кислотой, также как и с обычными кислотами, выделяется водород.
Металлы, находящиеся в ряду активности за водородом, с разбавленной серной кислотой не реагируют:

Рассмотрим особенности концентрированной серной кислоты.
Реакции с металлами
При взаимодействии концентрированной серной кислоты с металлами в роли окислителя выступают не ионы водорода, а входящий в состав кислотного остатка атом серы. Это приводит к следующим особенностям концентрированной серной кислоты:
1. H2SO4(к) является более сильным окислителем, чем обычные кислоты. Она реагирует практически со всеми металлами, в том числе с Cu, Ag и Hg, расположенными в ряду активности за водородом;
2. при взаимодействии H2SO4(к) с металлами водород (H2) не выделяется! Вместо водорода образуются продукты восстановления серы: 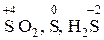 .
.
а) В отличие от обычных кислот, концентрированная серная кислота окисляет железо до степени окисления +3, а не +2:

Сравните продукты реакции железа с разбавленной и концентрированной H2SO4.
б) Концентрированная серная кислота реагирует со всеми металлами (кроме шести благородных металлов Au, Pt, Ir, Os, Rh, Ru):

в) Продукты восстановления серы ( ) зависят от условий протекания реакции, активности металла и концентрации кислоты. Чем выше активность металла и чем ниже концентрация кислоты, тем сильнее восстанавливается сера.
) зависят от условий протекания реакции, активности металла и концентрации кислоты. Чем выше активность металла и чем ниже концентрация кислоты, тем сильнее восстанавливается сера.
г) Концентрированная серная кислота без нагревания не реагирует с Fe, Al и Cr, так как поверхность этих металлов покрыта защитной оксидной пленкой. При нагревании указанные металлы реагируют с концентрированной серной кислотой:

Обратите внимание, с разбавленной серной кислотой Fe, Al и Cr реагируют без нагревания.
Учитель демонстрирует реакцию концентрированной серной кислоты с медной проволокой (проводить под тягой!).
Реакции с солями
Помимо высокой окислительной активности, концентрированная серная кислота обладает еще рядом особенностей. Она способна вытеснять сильные азотную и соляную кислоты из их твердых солей.
Возможность вытеснения серной кислотой других кислот из солей объясняется ее низкой летучестью. Температура кипения H2SO4 довольно высока и составляет 280 оС. Образующиеся в результате реакции между твердой солью и H2SO4(к) летучие кислоты HCl и HNO3, удаляются из реакционной системы в виде газа:
 .
.
Обратите внимание, подобные реакции не протекают с разбавленной серной кислотой (или раствором соли и концентрированной серной кислотой), так как HCl и HNO3 хорошо растворяются в воде и не могут удаляться из реакционной смеси.
Date: 2015-11-15; view: 3308; Нарушение авторских прав