
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры обозначения пространственных и точечных групп
|
|
Табл. 5.5
| Структура | Пространственная группа | Класс симметрии | |
| Краткий символ | Полный символ | Точечная группа | |
| Си, NaCl, CaF2 (ГЦК) | Fm3m | 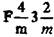
| m3m |
| С (алмаз) | Fd3m | 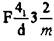
| mЗm |
| ZnS (сфалерит) | F4 3m | 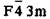
| 4 3гm |
| W (ОЦК) | Jra3m | 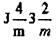
| mЗm |
| TiOi (рутил) | P4/mnm | 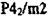
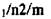
| 4/mmm |
| Mg,C (графит) | РбУmm с | 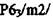
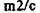
| 6/mmm |
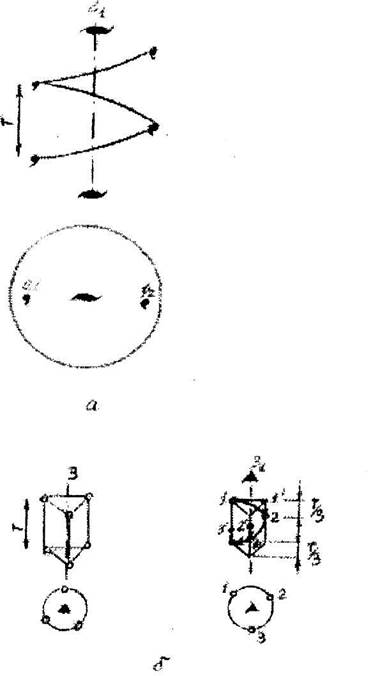
Рнс. 5,4. Действие осей 2 (а) н 3 (б)
В кратком символе группы указывают основные Э.С., а в полном -основные н производные от них.
Символ пространственной группы состоит из 4-х частей. На первое месте указывается тип ячейки Бравэ. (Р, С, J, F, R - ромбоэдрическая). На последующих местах ставятся Э.С. параллельные и перпендикулярные главным трансляционным направлениям (табл.5.6).
Главные трансляционные направления
Табл.5.6
| Сннгония | Главные направления | |
| Единичные векторы | Символы | |
| Моноклинная | 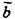
| [010] |
| Ромбическая | 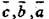
| [001], [010], [100] |
| Ромбоэдрическая Тетрагональная Гексагональная | 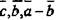
| [001],[010],[[110] |
| Кубическая | 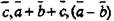
| [001] [111][110] |
| Тоиклинная | Нет главных направлений |
Если в главном направлении располагается ось симметрии, а пер-пендикулярно ей плоскость симметрии, то в числителе обозначается ось, а в знаменателе - плоскость. Если в главном направлении нет Э.С. то в символе ставят 1.
Рассмотрим пример записи ГЦК решетки. Первый символ будет F -тип ячейки Бравэ. В направлении [001] проходит ось 4, а перпендикулярно ей плоскости т, т.е. 4/т. Вдоль [111] проходит ось 3. В направлении [110] проходит ось 2, а перпендикулярно ей плоскость т, т.е. 2/т. Таким образом, полная запись пространственной группы; F4/m32/m или сокращенно Fm3ra. Например, сфалерит ZnS 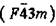 имеет
имеет
решетку типа алмаза  , но в узлах располагаются разного сорта
, но в узлах располагаются разного сорта
атомы, что и дает новую пространственную группу. Если уберем трансляцию, то получим соответствующие точечные группы:
Р222 - примитивная ячейка, три оси 2 параллельны главным направлениям. Наличие 3-х осей 2 характерно для ромбической сингонии. Таким образом^по символу пространственной группы можно установить сингонию, Э.С. и их расположение относительно координатныхосей.
Если на месте Э.С. континуума возникает Э.С. дисконтинуума, то в символе пространственной группы указывается новый Э.С. Например, вместо Р222 указывается 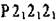 , если возникают винтовые оси.
, если возникают винтовые оси.
Если в пространственных группах исключать трансляцию, плоскости скользящего отражения и винтовые оси, то получим вновь 32 точечные группы.
Правильной системой точек называют совокупность симметрично-равных точек, связанных симметричными преобразованиями данной пространственной группы. Правильную систему точек можно получать из одной точки воздействуя на нее всеми Э.С. характерными для данной пространственной группы Таким образом, понятие правильной системы точек для пространственной группы аналогично понятию простой формы для точечной группы. Правильную систему точек используют для графического изображения пространственных групп.
Пространственная группа определяется с помощью рентгеноструктурного анализа. Знание правильной системы точек облегчает нахождение координат атомов в ячейке.
На рис.5.5,а показана правильная система точек группы Р1-триклинная сингония, примитивная ячейка, нет Э.С. Трансляция повторит точку А, перенеся еб в соседние ячейки, а в самой ячейке точка не повторится (симметрия системы равна!).

Рис. 5 5. Правильная система точек группы К
Чтобы избежать недоразумений в связи с возможным присутствием оси 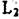 , как это следует из рисунка, точки правильной системы изображают с помощью асимметричных фигурок (рис.5.5,6).
, как это следует из рисунка, точки правильной системы изображают с помощью асимметричных фигурок (рис.5.5,6).
Подавляющее большинство кристаллических структур описывается 3 - 4 десятками пространственных групп. Для некоторых групп предста-вители еще не найдены.
Выводы
1. Воздействие оси трансляции на Э.С. континуума приводит к
новым Э.С. дисконтинуума: плоскости скользящего отражения и винтовые
оси.
2. Независимый набор сочетаний Э.С. дисконтинуума насчитывает
230 пространственных групп.
3. В обозначение пространственной группы вводится тип ячейки
Бравэ и Э.С, параллельные и перпендикулярные главным трансляционным
направлениям решетки.
4. Правильная система точек для каждой пространственной группы
выражает геометрические законы пространственного расположения
структурных единиц в кристаллах.
ЛЕКЦИЯ 8
Тема 6. Элементы кристаллохимии План
1. Атомные и ионные радиусы.
2. Координационное число. Число атомов в ячейке и плотность
упаковки.
3. Плотнейшие упаковки атомов.
4. Типы пор в алмазных структурах.
Кристаллохимия изучает связь структуры кристаллов с их физико- химическими свойствами. Эффективным радиусом г атома или иона является радиус сферы его действия. При этом атом (ион) считается несжимаемым шаром. Эффективный радиус иона зависит от степени заполнения электронных оболочек в соответствии с периодической таблицей Менделеева, но он не равен радиусу наружной орбиты, т.к. эти электроны обусловливают межатомную связь.
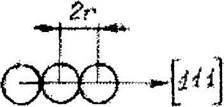
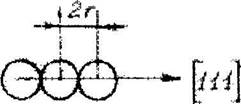
Для определения эффективного радиуса атомы (ионы) пред-ставляют как соприкасающиеся между собой жесткие шары. Расстояние между их центрами равно 2г. Атомные и ионные радиусы определяют экспериментально по измерениям параметров ячейки рентгеновским мето-дом (рис.6.1) и вычисляют теоретически на основе квантомеханических представлений.
|
|
А
Б
Рис, б, 1. К определению ионного радиуса в разных структурах по параметру ячейки (а-ОЦК,б-ГЦК)
Из простых геометрических построений можно показать: для ОЦК 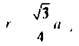
для ГЦК - 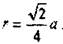
Для одного и того же элемента радиус аниона больше радиуса катиона, т.к. у аниона имеется избыток электронов. С возрастанием атомного номера и, следовательно, ростом числа электронных оболочек, возрастает и атомный радиус (исключение составляют элементы от лантана Z =57 до лютеция Z =71 и от актиния Z = 89 и далее. Это так называемые лантанидное и актинидное сжатие).
Координационным числом (К.Ч.) атома (иона) называют число ближайших к нему соседних атомов (ионов) одного сорта в кристаллической структуре. Соединив центры атомов ближайшего окружения прямыми линиями, получаем координационный многогранник (К.М.). Атом для которого строится координационный многогранник находится в его центре.
Так для алмаза К.Ч. = 4, К.М. -тетраэдр, для NaCl К.Ч. = 6, КМ. -октаэдр. Для CaF2 (флюорит) ион кальция окружен 8 ионами фтора, а ион фтора - 4 ионами кальция: К.Ч. CaF = 8 и К.М. - куб; К.Ч. FCa = 4, К.М. -тетраэдр. В меди (ГЦК) К.Ч. = 12, К.М. - кубооктаэдр. В магнии (ГП) К.Ч. = 12, К.М. - гексагональный аналог кубооктаэдра. В Мо (ОЦК) К.Ч. = 8, К.М. - куб.
Замечено, что атомный радиус зависит от координационного числа. Чем ниже К.Ч, тем меньше и атомный радиус. Обычно в справочных таб-лицах даются атомные радиусы для К.Ч. = 12, характерного для металлов (для полупроводниковых кристаллов К.Ч. = 4 или 6). Зная эти радиусы можно легко найти атомные радиусы для структур с разными К.Ч. (табл.6,1).
Изменение г от К.Ч.
Табл.6.1.
| К | ||||||
| г | 0.97 | 0.96 | 0.88 | 0.81 | 0.72 |
Компактность заполнения атомами объема решетки характеризует коэффициентом плотности упаковки или компактности К, определяемым как
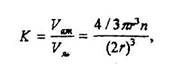
где п - число атомов в ячейке, 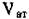 - полезный объем всех атомов в ячейке, Уяч - объем ячейки.
- полезный объем всех атомов в ячейке, Уяч - объем ячейки.
Для простой кубической решетки К = 0,52, для ОЦК К = 0,68, для ГЦК и ГПК = 0,74. Таким образом, даже в самых компактных структурах 26% общего объема решетки приходится на поры или пустоты.
Большинство химических элементов кристаллизуется в компактных упаковках. В ГЦК: Аи, Ag, Al, Си и др. В ГП; Zn, Mg, Be и др. В ОЦК: Мо, Cr^W.KHflp.
Определение стехиометрического состава вещества основано на подсчете числа атомов каждого сорта, приходящихся на элементарную ячейку. В структуре каменной соли NaCI (Рис.6.2), типичной для ионных кристаллов типа АВ, в построении ячейки участвуют 27 ионов обоих сортов (14 ионов СГ и 13 ионов Na+). Однако многие ионы входят в ячейку не полностью. Например, ионы в г нтрах граней одновременно принадлежат двум смежным ячейкам и их общий вклад будет: 6*1/2 = 3 иона. Ионы в вершинах дают вклад: 1/8*8 = 1 ион СГ. Т.е. всего в ячейке находится 4 иона. Ионы Na+ располагающиеся в центрах ребер одновременно участвуют в построении 4 ячеек, т.е. их вклад равен: 1/4*12 = 3 иона. Ион Na+ в центре принадлежит ячейке полностью. Таким
образом, в ячейке располагается всего 4 иона Na+ и стехиометрический состав вещества (А: В = 1: 1) выражается формулой АВ, т.е. NaCl.
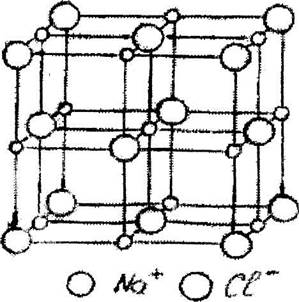
Рис. 6.2. Структура каменной соли
В ячейке гексагональной сингонии (рис.6.3) имеется два типа двугранных углов: 60° и 120°.
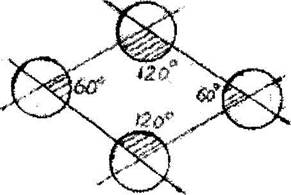
Рис. 6.3. К определению числа агомов
ячейки гексагональной сннгоннн
Из рисунка видно, что двугранные углы по 60° вырежут от каждого из 2-х атомов по 1/6 его части, а углы по 120° - по 1/3. В итоге 4 атома расположенных в вершинах дают вклад: 1/6 + 1/6 + 1/3 +1/3 = 1 атом на элементарную ячейку. Средний вклад каждого из этих 4-х атомов в
формирование ячейки будет равно 1/4, поскольку в одной плоскости соприкасаются 4 ячейки.
В простейших структурах для определения химической формулы можно использовать значения координационных чисел. Так, в структуре NaCl (К.Ч. 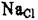 = 6, К.Ч.
= 6, К.Ч. 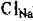 = 6) отношение координационных чисел 6; 6 -1:1, что дает стехиометрический состав АВ. В структуре флюорита К.Ч. Сар=8,К.Ч.
= 6) отношение координационных чисел 6; 6 -1:1, что дает стехиометрический состав АВ. В структуре флюорита К.Ч. Сар=8,К.Ч. 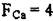 и стехиометрическая формула будет АВ2 или CaF2.
и стехиометрическая формула будет АВ2 или CaF2.
Число структурных единиц определяется числом атомов входящих в элементарную ячейку. Например, для NaCl число структурных единиц равно 8 (4 ионаИа* и 4 иона СГ).
Теория плотных упаковок предполагает, что атомы (ионы) - это несжимаемые шары. Таким образом, если структуру кристалла рассматривать как совокупность соприкасающихся между собою несжимаемых атомных сфер, мы приходим к чисто геометрической задаче об упаковке шарами пространства и нахождении размеров и конфигурации пор между ними.
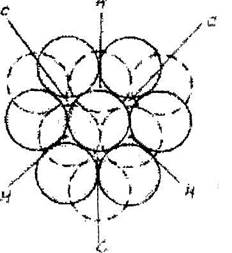
|
| Рис. 6.4. Плотная упаковка |
Рассмотрим простейший случай, когда все шары имеют оди-наковый диаметр. Это соответствует кристаллической структуре хи-мических элементов. Покажем, что равные шары можно уложить плотнейшим образом двумя способами. На рис.6.4 показан слой шаров, плотнейшим образом прилегающих друг к другу.
Каждый шар соприкасаеии с 6 шарам и окружен 6 лунками или порами. Каждая из пор окружена 3 шарами. Ясно, что перпендикулярно плоскости слоя проходят плоскости симметрии 6т - через центр каждого шара, Зт -через центр каждой поры. Число пор в слое вдвое превышает число шаров. Второй слой расположится над первым так, что все его шары будут находиться в лунках. При этом образуются лунки 2-х типов: сквозные типа "С" (лунка первого слоя находится над лункой второго) и несквозные типа "Н" (под лункой второго слоя находится шар первого слоя или наоборот). Лунка окружена 6 шарами расположенными по вершинам октаэдра и её называют октаэдрической (рис.6.5,6).
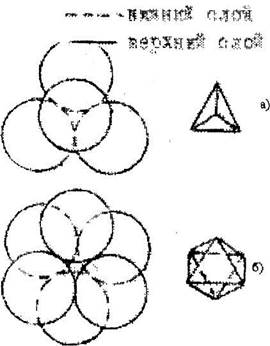
Рис. 6.5. Поры плотнейшей упаковки а - тетраэдрическая,
б - октаэдрнческая
Лунка "Н" окружена 4 шарами, центры которых образуют тетраэдр (рис.б.5,а). Такие поры называют тетраэдрическими. Количество пор типа "С"" равно числу шаров, а число пустот типа "Н"- вдвое больше.
Размеры пор характеризуются радиусом шара, который можно в них разместить. Радиус окгапоры - 0,41 г, атетрапоры - 0,22г.
Когда имеем двухслойную упаковку, то изменяется симметрия: исчезают оси 6, через шар и поры проходят только оси 3 и Зт.
Укладку шаров третьего слоя можно осуществить двумя путями: либр помещая шары в лунки "С", либо в лунки "Н", Если шары третьего слоя уложены в лунки типа "Н", то третий слой повторяет укладку первого. Получаем гексагональную плотнейшую упаковку (ГП) типа АВАВАВ...-плоскости (0001). Если шары третьего слоя располагаются в лунках "С ", то получаем плотнейшую гранецентрированную кубическую упаковку (ГЦК) типа ABC ABC ABC...
|
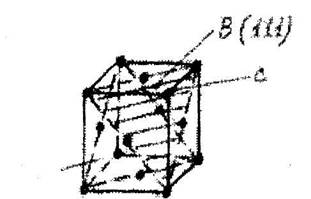
На рис 6.6 показана ячейка ГЦК с указанием послойного расположения атомов.
А'.
Рнс. 6.6. Послойное расположение атомов в ячейке ГЦК
Ось 3 совпадающая с направлением <111> перпендикулярна к плотноупакованным плоскостям {111} типа А,В,С. В ГЦК упаковке всего 4 направления <111> перпендикулярно которым располагаются плотнейшие слои.
Через центры окта-пор проходит ось 63. ГП упаковка характерна для металлов: Mg, Be, Zn, Cd, Tl, Ti, Hf, Os, и др., для интерметаллов: AgCd, AgCd3, AuCd, CuZn3, и др.
Из геометрического рассмотрения легко показать, что с/а должно равняться 1,633. Для большинства металлов с ГП структурой отношение с/а близко к теоретическому. Например, для Be: с/а= 1,58; Cd - 1,89; Mg -1,62; Zn - 1,86 и т.д.
В двухслойных упаковках (ГП) сквозные лунки "С" образуют сплошные каналы вдоль которых легко диффундируют атомы примеси. Структурой ГЦК обладают металла: Си, Аи, Ag, Al, Pb, y-Fe, Ca, Pb, Nb, Ni, Jr, Pt.
Все существующие в природе плотные упаковки представляют собой различное сочетание мотивов ГП н ГЦК. Так например, существует четырехсложная упаковка САВАСАВАСАВА..., пятислойная ВАВСАВАВСАВА... Для определения симметрии упаковок удобен другой способ обозначения.
n=2 ABABAB... (Рбз/mmC)
гг г г ггг
п=3 А В С А В С... (Fm3m)
к к к к к к
n=4 ABAC А В АС... (Рбз/mmC)
к г к г к г к г
n=5 ABC AB ABC... (P3ml)
гкккггкк
N=6 1)АВС АС В ABC... (Рбз/mmC)
г к к г к кг к к
2) А В ABAC ABA... (P6n2)
кгггкгкгг (к - мотив ГЦК обозначает плоскость лежащую между
разнотипными плоскостями, г - мотив ГП обозначает плоскость лежащую между однотипными плоскостями).
С ростом числа слоев растет и число вариантов каждой п-слойной упаковки. Так, шестислойных будет - 2, семислойных -3, восьмисложных -6, десятислойных -16, двенадцатисложных -43 и т.д.
Только упаковка ккк... принадлежит к кубической сингонии (Fm3m). Остальные плотнейшие упаковки принадлежат к гексагональной симметрии.
Если учесть, что.на один атом проходится 1 окта-пора и 2 тетра-поры, то общий объем занимаемый октаэдрическими и тетраэдрическими порами будет примерно одинаков.
Нарис.6.7 показано расположение пор в ГЦК ячейке.
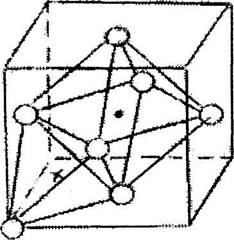
Рис. 6.7. Тетраэдрнческая (X) и
октаэдрнческая (О) поры в ГЦК решбтке
Октапоры находятся в центре ячейки и в середине ребер. Всего будет 8 тетра-пор на ячейку с координатами:

Как ранее было показано, 32% объема решетки ОЦК приходится на поры. Создается впечатление, что размер пор здесь должен быть больше. Однако, в действительности всё как раз наоборот.
| Рис, b.i, Тетра»дрическая(X) и окгаздрнческая (О) поры в ОЦКрешвтке |
На рис. 6.8. показаны поры в ОЦК ячейке.
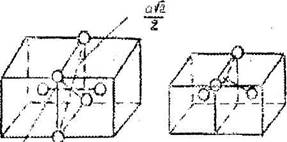
Окта-поры неравноосны и располагаются в центрах граней и ребер ячейки, атетрапоры по 4 находятся в гранях (рис.6.9).

Рис. 6.9. Расположение тетрапор (X) и октапор (О) на грани ОЦК
ячейки
В неравноосную окта-пору можно вписать шар радиусом всего 0,154г. Тетра-поры несколько больше и имеют радиус 0,291г. Большая "рыхлость" ОЦК решетки обусловлена большим числом пустот. На каждый атом здесь приходится 3 октаэдрические и 6 тетраэдрических пор, т.е. Зп и 6п соответственно (в ГЦК и ГП - In и 2п). Все поры одновременно в ОЦК решетке заполняться атомами примеси не могут, т.к. пор много и слишком мал их размер, что приводит к большим структурным искажениям. В ячейке ОЦК находится не более 1 атома внедрения. В ГП и ГЦК размер пор больше и они могут заниматься атомами примеси частично или полностью. Вследствие этого растворимость примеси внедрения в ОЦК решетках обычно ниже, чем в ГЦК и ГП.
Поскольку атомы компонента внедрения располагаются в порах кристаллической решетки растворителя, то теория твердых растворов тесно связана с теорией плотнейших упаковок атомов. В растворах внедрения атомы растворенного компонента располагаются в наиболее просторных порах. Так в ГЦК, ГП решетках это будут октапоры, в ОЦК -тетрапоры.
При образовании твердых растворов кристаллическая решетка искажается, т.к. атомные радиусы даже таких элементов, как углерод (г = 0,77 А0)., азот (г =0,71 А0), водород (г =0,46 А0) превышают размеры пор.
Выводы
1. Наивысшей компактностью обладают ГЦК и ГП структуры.
2. Для простых структур стехиометрический состав определяется
соотношением координационных чисел структурных единиц.
3. Упаковка Гп характеризуется мотивом АВАВ... Для упаковки
ГЦК характерен мотив АВСАВС...
4. Ввиду меньшего размера пор, растворимость атомов примеси
внедрения в ОЦК решетке меньш е, чем в ГЦК и ГП.
ЛЕКЦИЯ 9 Тема. Структура окислов металлов.
План
1. Характер расположения примесных атомов и ионов в решетке.
2. Структуры окислов металла типа хлористого натрия, флюорита,
рутила, корунда, шпинели, сфалерита, перовскита.
3. Окислы железа, молибдена, вольфрама, ванадия, кремния.
Химические соединения металлов с кислородом называют окислами, если образуется только одно соединение. Если несколько, то наиболее бедное кислородом называется закисью, а с большим содержанием кислорода -окисью. Например, Си2о- закись, а СиО - окись меди. Окислы металлов применяют как конструкционные материалы, электрические изоляторы, полупроводники, магнитные материалы, пигменты красок и т.д. Большинство металлов получают восстановлением окислов. В то же время металлы, постепенно окисляясь, снова превращаются в окислы.
Кристаллы многих простых окислов металлов состоят из гексагональной или кубически плотноупакованной решетки из ионов кислорода или металла, с соответствующим заполнением окта- или тетра-пор.
Структура типа хлористого натрия. В структуре NaCl анионы Сl имеют ГЦК решетку, а катионы Na+, размер которых меньше размеров анионов, занимают октаэдрические поры. Каждый катион окружен 6 ионами кислорода. Этой структурой обладают такие окислы как MgO, CaO, SrO, BaO, CdO, NiO, MnO, FeO, TiO, NbO, VO. На рис.9.1. показана кристаллическая структура NaCl.
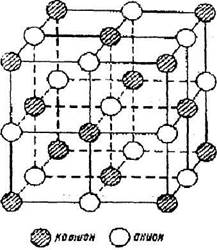
|
Рис. 9.1. Кристаллическая структура NaCl
Известно несколько окислов металла типа МО (М - металл), в которых ионы М находятся в тетраэдрической координации. Например ВеО и ZnO. Здесь ионы М занимают 4 тетра-поры решётки, (структура вюрцита).
Структура типа флюорита ( CaF2). Анионы 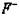 занимают все 8тетра-пор ГЦК решетки катионов
занимают все 8тетра-пор ГЦК решетки катионов 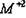 . В такой структуре каждый ион М окружен 8 анионами. Например для иона М находящегося в центре грани ячейки, 4 аниона располагаются вверху и 4 - внизу в параллельных плоскостях по вершинам куба. В то же время, каждый анион находится в тетраэдрическом окружении. Кристаллическая структура флюорита (CaF2) представлена на
. В такой структуре каждый ион М окружен 8 анионами. Например для иона М находящегося в центре грани ячейки, 4 аниона располагаются вверху и 4 - внизу в параллельных плоскостях по вершинам куба. В то же время, каждый анион находится в тетраэдрическом окружении. Кристаллическая структура флюорита (CaF2) представлена на
рис.9.2.
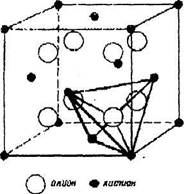
Рис. 9.2. Кристалшческая структура флюорита (CaFj)
81
Окраска кристаллов, в зависимости от примесей,
розовая, фиолетовая, желтая, бесцветная. Под действием рентгеновских лучей зеленая окраска переходит в розовую. Кристаллы обладают флуоресценцией. Применяются для изготовления призм в рентгеновских спектральных приборах, в сцинцилляционных счетчиках, с примесями редких зецель - в оптических генераторах.
Вюрцитная структура довольно близка к структуре CaF2. Она может быть получена из последней удалением половины анионов. Структуру
Date: 2015-09-24; view: 2190; Нарушение авторских прав