
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Флюрита Имеют ОКИСЛЫ ZrO2,Hf02,Ge02,U02,Th02,Pu02 И др
|
|
Окислы щелочных металлов  обладают
обладают
структурой типа антифлюорита, в которой анионы кислорода могут рассматриваться как плот неупакованные, а катионы - занимающие все тетраэдрические позиции. Следует заметить, что Си2О имеет другую структуру, в которой каждый ион кислорода находится в тетраэдрическом окружении, 4-х ионов меди, а катионы имеют по два ближайших кислородных аниона.
Структура типа рутила 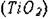 . Ионы металла находятся в окта-
. Ионы металла находятся в окта-
эдрическом окружении. Структуру рутила можно рассматривать как состоящую из октаэдров  , соприкасающихся рёбрами и вершинами (рис.
, соприкасающихся рёбрами и вершинами (рис.
|
| Рис. 9.3. Кристаллическая структура рутила (TiО2) |
9.3.)■
82
Ячейка тетрагональная центрированная. Кислородные
октаэдры несколько искажены. Кристаллическая структура рутила (ТiO2) представлена на рис.9.3.
Рутил встречается в природе в виде игольчатых или призматических кристаллов. Цвет - от золотисто-желтого до черного, в зависимости от примесей. TiOг - полупроводник. Структуру типа рутила (правильную или искаженную) имеют окислы SnO2, MtO2, VO2, МОг, WОг,, RuОг, и др.
Структура типа корунда (a-Alг Os). Состоит из О'г гексагонально плотноупакованных ионов (по мотиву АВАВ.) и Аl3, занимающих 2/3 октапор (всего п окта-пор на ячейку с п атомами). Ион М окружен 6 анионами O ~2, в то время как каждый ион кислорода находится в кружении 4-х атомов М. Структурой типа корунда обладают окислы: a-FeгО3, CrгО3, TiгО3, VгО3 и др. Добавкой ионов Сг получают красный корунд-рубин (от 0,05% - бледно розовый цвет до 0,5% - темно красный). В связи со специфическим спектром поглощения рубин используется в оптических квантовых генераторах. При 8% О+3 корунд становится зеленым. Добавки различных примесей придают корунду разные цветовые оттенки: V -серовато-зеленый, при дневном свете и фиолетовый при искусственном освещении, Мn -желтовато-розовый, Ni - желтый, Ti - розово-фиолетовый. Цветные корунды (восточный топаз, александрит, изумруд, аметист, сапфир, кунцит) применяются в ювелирной промышленности. Корунд применяется как абразивный (алунд) и огнеупорный материал. Из мелкокристаллического корунда методами порошковой металлургии изготовляют резцы для механической обработки металлов при высокой температуре. Рубины используют так же в качестве опорных камней для часов и точных приборов. Структура типа шпинели (МgА12О4). Атомы кислорода имеют плотно упакованную ГЦК решетку (мотив ABCABC....), а ионы металлов занимают частично окта- и тетра-поры. В элементарную ячейку входят 32 атома
октаэдрических пор занята ионами Al+3, в то время как ионы Mg +2занимают одну из 8 тетраэдрических пор, т.е. всего 8 пор. Шпинели с таким распределенном двухзарядных ионов в тетраэдрических позициях, а трехзарядных - в октаэдрических, называютсянормальными.
Встречаются и другие распределен я катионов. Если в ячейке 8 тетраэдрических пор заняты М+3, а в октаа-порах расположены и двух-и трехзарядные ионы, то такая структура называется обратной шпинелью. Например, магнетит Fe3O4 обладает структурой обратной шпинели.
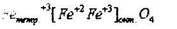
Структура перовскита СаТiO3 Ионы Ti+ располагаются по узлам
примитивной ячейки, О -2- в середине рёбер, Са +2 - в центре ячейки. В этой структуре кристаллизуются ВаТiО3 , CaZrO3 РbТiО3 многие из которых
являются сегнетоэлектриками.
Простые окислы железа. В системе Fe-O2 образуется три окисла: вюстит (FeO), магнетит (Fe3О4) и гематит (Fe2О3) В основе структура вюстита и магнетита лежит ГЦК кислородная подрешетка. Вюстит, как уже говорилось, имеет структуру NaCl, а магнетит - шпинели. Гематит обладает структурой корунда.
Простые окислы Мо и W. В системе Мо-О2 образуется МоО2> МоОг
и ряд окисных фаз в области МоО2-МоО3: Мо9O26, Мо8O23, Мо17O47,Мо5O14 Мо4О11. При температурах выше 820°с стабильны только МоО2, и МоО3, причем МоО3 плавится при 795°с. МоО2 имеет искаженную структуру рутила (моноклинную). Структура МоО3 состоит из непрерывных цепей кислородных тетраэдров вдоль плоскостей (001).
Система W-O2 включает окислы Wl8O49, WO2, W20O58, WO3. Окислы
Wl8O49 и W20O58 нестабильна при низких температурах. WО3 имеет разные кристаллические модификации: тетрагональную (>740°С), ромбическую
(330-740°С), моноклинную (17 - 330°С), триклкнную 0 (-40 - 17°С) и а (-40°С). WO2 имеет искаженную структуру рутила. Структура 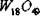 и
и 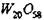
моноклинная.
Окислы кремния. Окись кремния SiO существует в газовой фазе. При быстрой конденсации возможно образование SiO в твердом состоянии, который распадается на Si и SiO2. Двуокись кремния SiO2 с учетом кристаллической и аморфной форм может существовать в 15 различных модификациях, из которых при атмосферном давлении стабильны 4; 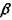 - кварц (стабилен ниже 573°С), а - кварц (573-867°С), а- тридимит (867-1470°С) и а- кристобалит (от 1470°С до точки плавления). Структура ли
- кварц (стабилен ниже 573°С), а - кварц (573-867°С), а- тридимит (867-1470°С) и а- кристобалит (от 1470°С до точки плавления). Структура ли 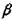 - кварца, а также а-трнднмита гексагональная.
- кварца, а также а-трнднмита гексагональная. 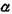 - кристобалит имеет ГЦК решетку.
- кристобалит имеет ГЦК решетку.
Окислы ванадия. Ванадий способен растворять большие количества кислорода (до 3 ат. %). В системе V -О2 обнаружено большое число фаз:
объемно-центрированная тетрагональная (у?- фаза) с содержанием кислорода от 15 до 25 ат. %, у- фаза 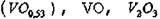 ; фазы гомологического ряда
; фазы гомологического ряда
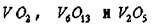 ■
■
ВЫВОДЫ
1. Кристаллы большинства простых окислов металлов состоят из
гексагонально или кубически плотноупакованных ионов кислорода или
металла с соответствующим заполнением окта- или тетра-пор.
2. В системе Fe-O2 образуется три окисла. 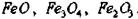
ЛЕКЦИЯ 10-11 Тема. Рост кристаллов
План
1. Гомогенное и гетерогенное образование зародышей.
2. Факторы, влияющие на огранку кристаллов.
3. Закон постоянства углов в кристаллах.
4. Практические методы выращивания монокристаллов.
Кристаллы могут образовываться путем фазового перевода из любого неупорядоченного состояния: их паров., растворов, расплавов, из аморфного состояния или из другой кристаллической фазы (путем перекристаллизации). Переход в кристаллическое состояние - это качественный скачок при строго определенной температуре кристаллизации. На первом этапе возникает субмикроскопический зародыш кристаллической фазы критического размера, способного к дальнейшему росту. Второй этап - дальнейший рост этого зародыша. Вероятность образования зародыша тем больше, чем больше степень переохлаждения (или пересыщения). Если зародыш достиг критической величины, кристаллизация идёт далее спонтанно, т.к. процесс сопровождается уменьшением свободной энергии системы. Такое самопроизвольное образование зародыша внутри метастабильной фазы называется гомогенным. При гетерогенном зарождении зародыши образуются на частицах другой фазы; пылинках, частицах примеси, на неровностях стенки сосуда, на введенных в качестве затравки в раствор или расплав кристалликах. В промышленных методах чаще реализуется гетерогенное зарождение. Применяя затравки с определенной кристаллографической ориентацией или придавая им особую форму выращивают кристаллы заданной ориентировки и требуемой формы.
Расчеты молекулярно- кинетической теории
показывают, что рост кристаллов происходит путём подхода атомов к локальным нарушениям структуры, например, к выходу (ступеньке) винтовой дислокации (см. ниже).
На форму растущего кристалла влияют такие факторы, как концентрационные потоки (вблизи растущего кристалла концентрация вещества падает и возникает градиент концентраций), колебания температуры (раствор становится то недосыщенным и кристалл начинает растворяться, то пересыщенным - кристалл начинает расти), наличие примесей, вязкость раствора. Например, если кристалл лежит на дне сосуда, то под действием концентрационных потоков он стремится стать плоским, а в подвешенном состоянии - вытянутым. Раствор с пониженной концентрацией становится легче и поднимается вверх. Чтобы избежать влияния этих потоков кристалл вращают вокруг горизонтальной оси.
При быстрой кристаллизации кристаллики часто имеют так называемую скелетную форму или дендритную (форму разветвленного дерева). Характерный пример скелетных кристаллов - снежинки. Это кристаллики, у которых интенсивно растут вершины, рёбра, но обычно не вырастают плоские грани. Самородные металлы: золото, серебро, медь и др. часто встречаются в форме дендритов. Знаменитый дендритный «кристалл Чернова» более 40 см длиной был найден внутри 100 т металлического слитка.
Гиббс (1878 г.) высказал предположение, что во время роста кристалл стремится принять более устойчивую - равновесную форму. Равновесной формой кристалла называют такую его огранку, которая при данном его объеме соответствует минимуму поверхностной энергии, затрачиваемой на его образование.
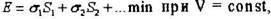
где Е - полная поверхностная энергия,  - площадь граней, имеющих поверхностные натяжения
- площадь граней, имеющих поверхностные натяжения 
На практике обычно приходится иметь дело с кристаллами, не имеющими равновесной формы. Скорость роста различных граней кристалла может различаться, ввиду неравномерного питания раствором растущего кристалла с разных сторон. Этот случай довольно типичен для природы. Неравномерное развитие одинаковых по строению граней затрудняет изучение симметрии внешних форм кристалла. Однако, еще Ломоносовым (1749 г.) было замечено, что при росте кристалла его определенные грани, вне зависимости от скорости роста, образует между собой постоянные углы, т.е. грани растут параллельно самим себе, Вследствие такой параллельности движения граней при их росте углы между двумя любыми гранями растущего кристалла всегда остаются постоянными. На рис.10.1. показано передвижение граней при росте кристалла,
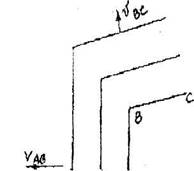
|

|
Рис. 10.1. Перемещение граней при росте кристаллов
Как видно угол между гранями ABC в процессе роста не изменяется (VAB и VBC скорости роста граней АВ и ВС соответственно).
Здесь скорость VAB < VBC- Грани с наибольшей ретикулярной плотностью имеют наименьшую скорость роста, т.к. к ним необходим подвод большего количества вещества. Наоборот грани с меньшей ретикулярной плотностью растут быстрее (рис. 10.1, б). Грань ВД с малой
ретикулярной плотностью быстро растет и исчезает Таким образом, кристалл ограняет себя плоскостями с малыми кристаллографическими индексами. В реальных условиях одинаковые грани кристалла растут быстрее, другие медленнее. В конечном итоге это приводит к. различным внешним формам кристаллов одинаковых веществ. Таким образом, в зависимости от условии роста число, форма и размеры граней изменяется. Неизменными остаются лишь углы между определенными гранями растущего кристалла. Закон постоянства углов объясняется одинаковым внутренние строением, т.e. атомной структурой вещества. Однотипные грани разных кристаллов данного вещества состоят из одинаковых атомных сеток и поэтому должны образовывать между собой равные углы. Закон постоянства углов дал возможность свести всё многообразие форм многогранников к совокупности углов межу гранями и изобразить их с помощью проекций. Теперь анализ кристаллов можно было вести измеряя углы между гранями с помощью угломерного прибора- гониометра. Такой гониометр, работающий по принципу отражения светового пуча от граней, был разработан Федоровым Е.С. Он широко используется в кристаллографической практике и походных геологических лабораториях. До развития рентгеноструктурного анализа гониометрический метод наряду с химическим, по-существу, были единственными методами диагностики кристаллов.
Существует следующие способы выращивания кристаллов: 1. Образование кристаллов из газообразного вещества (так возникают морозные узоры, образуются снежинки, узоры различных солей на стенках химической посуды и т.д.). Природные кристаллы серы возникли в виде осадка из газообразного выделения вулканического происхождения.
2. Кристаллизация из пересыщенных растворов. Раствор, в котором уже не растворяется вещество, но и нет его в избытке в виде осадка называют насыщенным Обычно растворимость веществ увеличивается с
ростом температуры и падает с ее понижением. Поэтому постепенно понижая температуру насыщенный раствор легко перевести в пересыщенный. При этом частицы растворенного вещества начинают группироваться образуя вначале зародыши, которые вырастают в более крупные кристаллы.
3. Кристаллизация из расплавов (лед из воды, металл, корунд из расплава).
4.Перекристаллизация в твердом состоянии. Например,
закристаллизованные стекла; крупнокристаллические образования, получающиеся после нагрева деформированного металла. При деформации зерна металла сильно измельчаются. Металл, поглотивший эту энергию деформации, является неустойчивым или метастабильным. Кристаллическая решетка имеет большую избыточную поверхностную (формоизменение) и внутреннюю (дефекты решетки) энергию. При нагреве такого (наклепанного) металла происходят выделение энергии деформации за счет избавления решётки от искажений и роста последующего недеформированных зерен, приводящих к уменьшению общей свободной энергии.
Выращивание кристаллов из паров используется в основном для получения э пит аксиальных пленок и нитевидных кристаллов. Методы сублимации, т.е. кристаллизации вещества из собственного пара используют для веществ, которые легко сублимируются, не переходя в жидкую фазу (нафталин» иод, карбид кремния, CdS и др.).Для кристаллизации из газообразной фазы широко используют химические транспортные реакции. На рис. 10.2. показана схема выращивания кристалла CdS по методу такой газотранспортной реакции. Здесь А - печь, В - сосуд на дне которого находится металлический Cd, С - ввод Н2, Д - ввод H2S, E - вывод продуктов реакции.
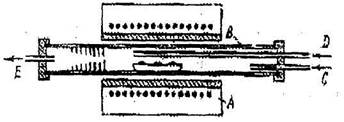
Рис. 10.2. Схема выращивания кристалла С dS по методу газотранспортной реакции
Схема метода транспортной реакции заключается в том, что над исходным веществом проходит поток газа, образующего и уносящего с собой газообразные продукты реакции, которые затем осаждаются в зоне кристаллизации. Так монокристальные пленки CdS выращивают при непрерывном потоке н2 и h2s над металлическим кадмием.
Способ выращивания из растворов основан на диффузии молекул растворённого вещества к растущему кристаллу при понижении температуры или увеличении концентрации. Выращивание обычно происходит на кристаллах-затравках. Этим способом выращивают совершенные кристаллы без внутренних напряжений, хорошо ограненные, очень крупные (до десятков кг). Дефективность кристаллов тем ниже, чем меньше скорость роста (обычно составляет сотые доли мм/час). Процесс кристаллизации иногда может длиться длиться неделями или даже месяцами. Из растворов выращивают кристаллы водорастворимых сегнетоэлектриков (сегнетова соль, триглицинсульфат), селитру, сахар и др. На рис. 10.3 показана схема выращивания кристаллов из раствора методом охлаждения с использованием кристалла-затравки.
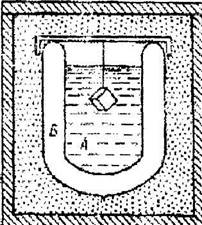
 Рис. 10.3. Схема выращивания кристаллов из раствора методом охлаждения
Рис. 10.3. Схема выращивания кристаллов из раствора методом охлаждения
Выращивание кристаллов из расплавов применяется в промышленности наиболее широко. В зависимости от способа отвода тепла в расплаве все методы подразделяются на несколько групп:
1. изменение температуры при неподвижном тигле;
2. перемещение кристалла в поле температурного градиента;
3. перемещение тигля или печи в поле температурного градиента;
4. бестигельные методы.
Преимуществами методов кристаллизации из расплавов является простота аппаратуры, высокие скорости роста (десятки мм/час), возможность выращивания очень больших кристаллов до нескольких десятков кг. Однако получающиеся кристаллы имеют большое количество дефектов решетки, возникающих из-за температурных напряжений роста и при охлажднии готового кристалла. После выращивания кристалла обязательно проводят его отжиг.
Практическое применение нашли следующие методы выращивания;
1. метод Киропулоса (относится к 1-й группе);
2. метод Чохральского (2-ая группа методов);
3. метод Бриджмена-Сгокбаргера (3-я группа методов);
4. метод Вернейля (4-ая группа методов).
Метод Киропулоса был разработан в 1926 г. Вещество для кристаллизации расплавляется в платиновом тигле со значительным перегревом (рис.10.4).
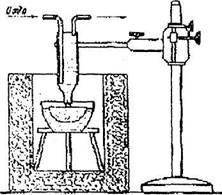
Рис. 10.4. Схема установки для выращивания кристаллов из
расплава методу Киропулоса
Трубку холодильника (изготавливается из платины, а внутренняя трубка из меди) опускают в расплав и начинают пропускать через неё воздух или воду с целью охлаждения трубки. На конце холодильника образуется мелкокристаллический нарост вещества в форме полусферы (рис. 10.5).
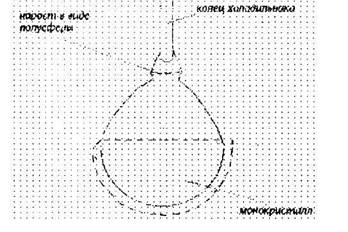
Рис. 10.5. Монокрнстальная "буля"
Это так называемая монокристалльная "буля". После этого увеличивают дутьё и начинают очень медленно поднимать трубку холодильника. Когда полусфера приходит в соприкосновение с поверхностью расплава, из
большого количества кристалликов полусферы «выживает» один. Этот кристаллик растет при подъеме и вращении холодильника. Этим методом успешно выращивает кристаллы KCI,NaCl, КВг и некоторых металлов.
Метод Чохральского применяют в основном для выращивания полупроводниковых кристаллов: Ge, Si, GaAs, JnSb и др., а так же монокристаллов некоторых металлов. Затравка, опущенная в расплав, смачивается им и приподнимается над его поверхностью (рис. 10.6).
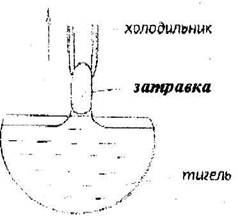
Рис. 10.6. Схема выращивания кристаллов из расплава по методу
Чохральского
Подъемный механизм постепенно поднимает холодильник, охлаждаемый проточной водой, вместе с затравкой. Если в методе Киропулоса кристалл растет в расплаве, то в методе Чохральского - над расплавом. При этом скорость вытягивания монокристалла из расплава должна быть равна скорости кристаллизации. Преимущество этого метода в том, что здесь размер растущего кристалла не ограничен стенками сосуда.
В методе зонной кристаллизации исходный материал находится в ампуле, в которой имеется затравка. В узкой зоне около затравки плавится материал узкиминдукционным нагревателем. Далее расплавленная узкая зона перемещается вдоль ампулы и кристалл - затравка начинает расти. При росте кристалла происходит и очистка материала от примесей. Примесь уходит в конец кристалла. Высокая степень очистки достигается при
многократном перемещении зоны и отрезкой концов кристалла обогащенных примесью. В соответствии с типовой диаграммой состояния концентрация примесей в жидкой фазе - 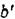 , как правило, превосходит концентрацию в жидкой фазе - а', рис 10. 7
, как правило, превосходит концентрацию в жидкой фазе - а', рис 10. 7
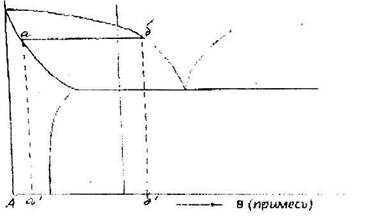
Рис. 10.7. Диаграмма состояния с ограниченной растворимостью компонентов в твердом состоянии
На этом принципе основан метод зонной плавки, являющийся лучшим методом очистки материалов.
В лодочку из термостойкого инертного материала (например,плавленный кварц) загружают поликристаллический исходный материал (шихту), который следует очистить. С помощью индукционного нагревателя в вакууме производится местный (локальный) разогрев участка материала до его расплавления (рис. 10.8).

Рис. 10.8. Схема горизонтальной зонной очистки металла
Далее индукционный нагреватель перемещается вдоль всей лодочки с определенной скоростью.
Зонную плавку ведут часто и без лодочки, чтобы не вызвать загрязнения очищаемого материала веществом лодочки. В этом случае поликристаллический материал укрепляется в специальных вертикальных держателях. Расплавленная (индуктором) зона удерживается силами поверхностного натяжения и магнитным полем высокой частоты. (Рис. 10.9).
|
Рис. 10.9. Схема вертикальной зонной
очистки металла
Для зонной плавки тугоплавких металлов (W, Мо, Та) используют нагрев с помощью электроннолучевого нагревателя. Под действием высокого напряжения (несколько киловольт) электроны испускаемые катодом ускоряются и бомбардируют слиток в области анода, обеспечивая сильный местный разогрев до 3500°с. Оптимальная скорость перемещения расплавленной зоны изменяется для разных материалов в пределах 1-20 см/час. В целях лучшей очистки вещества осуществляется многократный проход зоны нагрева вдоль слитка. При этом каждый раз концы слитка, где скапливаются примеси, отрезают и последующей зонной плавке подвергают остаавшуюся часть.
Процесс этот может быть ускорен если вдоль слитка расположить ряд нагревателей, дающих сразу несколько расплавленных зон. Качество очистки зависит от многих факторов: длины зоны, длины слитка, числа проходов, скорости перемещения зоны, степени перемешивания расплава.
Методом зонной очистки получают металлы и полупроводниковые соединения чистотой до 99,9999% и выше. Зачем нужны ультрачистые металлы? В промышленности можно найти много примеров, когда присутствие примесей даже в очень малых количествах оказывает вредные влияния на механические, электрические, магнитные и другие свойства металлов. Эти примеры являются результатом горького опыта, когда многие тонны металла не могли быть использованы и уходили в брак из-за непредвиденных отрицательных эффектов, вызванных некоторыми примесями. Например, очень малое содержание Bi охрупчивает медь, Я2 - Ti,
Cd и Sn - Zn (пример с Чирчикским заводом - забраковано несколько партий монокристаллов W и Мо из-за повышенного содержания О2).
Полупроводниковая промышленность требует достижения фантастически малого содержания примесей менее 10"6% (цена за 1 кг - 4500 долларов). Кроме того, получение чистого вещества позволяет получить представление об его истинных свойствах. Чем чище металл, чем более совершенна его кристаллическая структура, тем более точно определить такие важные параметры, как точка плавления, плотность, упругие постоянные и др.
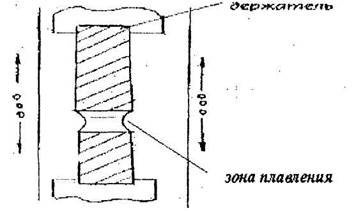
Метод Бриджмена-Стокбаргера (1925г) широко используется для получения монокристаллов легкоплавких металлов таких, как например Zn. Кварцевая ампула (рис. 10.10,а) с вытянутым в капилляр нижним концом наполняют расплавом вещества и подвешивают в вертикальном положении в трубчатой электропечи. Распределение температуры по высоте печи при температуре кристаллизации 950°С показано на рис. 10.10,6.
c. 10.10. Схема выращивания кристаплов нз расплава по методу Брнджыена-Стокбаргера
При постепенном опускании ампулы и по выходе капилляра из зоны нагрева в нём после явления отбора начинает расти один кристалл. В конечном счёте вся ампула заполняется монокристаллом.
|
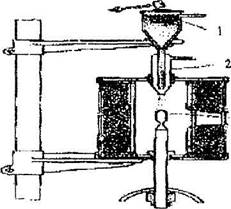
| Рис. 10.11. Схема выращивания кристаллов из расплава по методу Вернейля |
Метод Вернейля (1934 г) применяют при выращивании тугоплавких монокристаллов (например, корунда). Кристаллизуемое вещество в виде тонкого порошка помещают в сосуд с сетчатым дном (рис. 10.11).
При строго периодических ударах молоточка по воронке, порошок вещества осыпается вдоль трубки вниз на свечу из тугоплавкого материала. В высокотемпературном пламени гремучего газа 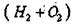 вещество спекается,
вещество спекается,
оплавляется и постепенно нарастая вверх дает монокристальную «булю».
ВЫВОДЫ
1. Форма растущего кристалла зависит от условий его роста.
2. Грани с наибольшей ретикулярной плотностью имеют наименьшую
скорость роста,
3. Кристаллы получают из газовой фазы» пересыщенных растворов, из
расплавов, перекристаллизацией в твёрдом состоянии.
4. Наибольшее, распространение получили методы выращивания
кристаллов из расплавов: Киропулоса, Чохральского, Бриджмена-
Стокбаргера, Вернейля.
5. Глубокая очистка металлов возможна использованием метода
зонной кристаллизации (очистки).
ЛЕКЦИЯ 12
Тема. Дефекты кристаллической решётки. Раздел. Введение в теорию дефектов.
План
1. Работы Аносова П.П. и Чернова Д.К. в области металловедения.
2. Опыты Лауэ и работы Вульфа и Брэггов.
3. Частотный спектр кристалла.
4.. Жбсткий сдвиг и теоретическая прочность кристаллов. 5. Реальная прочность кристаллов.
Представление о кристаллической структуре металлов сформировалось к концу 19 века благодаря работам наших отечественных инженеров: Павла Петровича Аносова и Дмитрия Константиновича Чернова. П.П. Аносов впервые использовал травление кислотами сталей и применил микроскоп для исследования структуры. Первым установил связь структуры с механическими свойствами. Открыл утерянный секрет изготовления булатной стали (1833 г).
Занимаясь исследованием строения мест разрыва артиллерийских стволов Д.К.Чернов установил, что при мелкозернистом строении пушки служат долго и предложил технологию получения такой структуры. Об этом он доложил в своих выступлениях на заседаниях Русского технического общества (1868 - 1878 гг.). Впервые обнаружил критические точки фазовых переходов в стали (точки Чернова) и заложил основы металлографии.
"Весь процесс обработки металла определяется только кристаллами, из которых сложен металл" - писал Д.К. Чернов. Чтобы можно было управлять прочностью, физическими и механическими свойствами металлов и сплавов, создавать новые жаропрочные сплавы для космической техники, сплавы с высокой износостойкостью и др., очевидно необходимо знать
100
строение отдельных кристаллов (кристаллитов или зерен),
особенности их связи друг с другом» механизмы процессов происходящих в микромире и определяющие макросвойства.
В начале XX века в 1912г было экспериментально подтверждено опытами Лауэ на кристаллах ZnS и в 1914 г. работами Вульфа и Брэггов наличие закономерного расположения атомов в объеме кристалла. Опыты Лауэ показали, что при облучении кристалла рентгеновскими лучами, последний ведет себя как трёхмерная дифракционная решетка (при соизмеримости длины волны -Л излучения с межатомным расстоянием- а).
В идеальном монокристалле все атомы находятся в положении равновесия, определяемого минимумом потенциальной энергии (рис. 12.1).

Рис. 12.1. Зависимость потенциальной энергии от расстояния г между атомами
Здесь 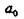 - межатомное расстояние для кристалла при
- межатомное расстояние для кристалла при 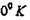 . При
. При
Т^0°/Гатомы совершают гармонические колебания вокруг положений своего термодинамического равновесия подобно колеблющимся осцилляторам с амплитудой до ± 20% от 
Частотный спектр кристалла достаточно сложен, изменяется при легировании и образовании вторых фаз и простирается от 0 до 1013 Гц. Например, для ОЦК кристаллов спектр частот v колебаний атомов имеет вид представленный на рис. 12.2.
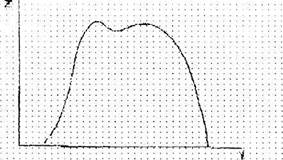
Рис. 12.2. Частотный спектр кристалла с ОЦК решёткой
Здесь Z - число колебаний данной частоты v. Таким образам, идеальный кристалл - это лишь модель кристаллической решйтки, симметричная. и не имеющая никаких нарушений строения. В действительности же, как только что отмечалось, атомы из-за тепловых флуктуации не находятся строго в своих положениях равновесия. И, следовательно, для каждой температуры можно говорить только о некотором среднем значении 
В 20-х годах представление о кристалле, как правильной системе колеблющихся атомов-осцилляторов было применено к расчету теоретической прочности кристалла (упругое тело Гука). Чтобы разрушить кристалл, необходимо разорвать межатомные связи. Очевидно, прочность кристалла должна быть пропорциональна произведению сил связи на число атомов в сечении кристалла: 
Представим себе две плоскости атомов, связанные межатомными силами, на которые действуют напряжения сдвига  . Поскольку в положении равновесия атомы находятся в потенциальных ямах, то г должно изменяться в плоскости жесткого сдвига М-М по периодическому закону с периодом в, На рис.12.3 показан сдвиг верхней части кристалла относительно нижней одновременно по всей плоскости М-М.
. Поскольку в положении равновесия атомы находятся в потенциальных ямах, то г должно изменяться в плоскости жесткого сдвига М-М по периодическому закону с периодом в, На рис.12.3 показан сдвиг верхней части кристалла относительно нижней одновременно по всей плоскости М-М.
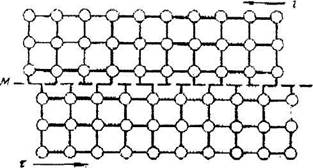
|
| — м |
Рис. 12.3. Сдвиг верхней части кристалла относительно нижней одновременно по всей
плоскости М-М
Как показал Я.И. Френкель 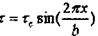 . Здесь х - смещение атомов
. Здесь х - смещение атомов
при сдвиге, 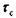 - амплитудное значение напряжений сдвига.
- амплитудное значение напряжений сдвига.
Как видно 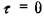 при х = 0, в и в/2.
при х = 0, в и в/2.
Изменение энергии атомов и силы межатомного взаимодействия плоскостей I и II при смещении одной плоскости относительно другой показано на рис.12.4.
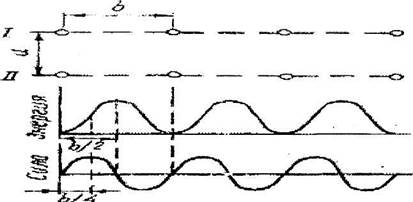
Рис. 12.4. Изменение энергии атомов и силы межатомного взаимодействия плоскостей I и П при смещений одной
плоскости относительно другой
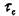 определяется из условия, что начальный наклон кривой
определяется из условия, что начальный наклон кривой 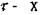
должен соответствовать модулю сдвига G - материала. В начальный момент сдвигах - мало и можно использовать приближение:
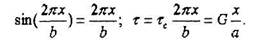
Здесь (-) - относительная деформация при сдвиге. Окончательно а
инеем
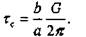
Скалывающее напряжение достигает максимума (г.) при
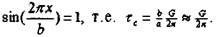
Например, для Fe:
 для Си:
для Си:

Реальная же прочность этих металлов на сдвиг существенно ниже и составляет: для Fe 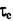 = 200н/мм2; для Zn:
= 200н/мм2; для Zn: 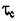 = 40н/мм2;: для Си:
= 40н/мм2;: для Си: 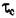 = 100н/мм2.
= 100н/мм2.
Как видно, различие чрезвычайно велико: в 50 -150 раз. Опыты на отожженных высокочистых металлах показали ещё большее несоответствие теоретической и реальной 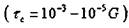 прочности. Таким образом,
прочности. Таким образом,
различие составляет 2-4 порядка. Для сравнения, высокопрочная сталь имеет прочность 1-2 ГПа, а высокопрочная - от 3-х до 6 ГПа. Необходимо установить причину такого несоответствия.
При наличии тепловых флуктуации атомов можно ожидать, что с повышением температуры будет нарушаться строгий порядок чередования атомов. Отдельные атомы, получившие вследствие термической активизации достаточную энергию, могут выйти из своих положений равновесия и занять положение в соседнем узле (вытеснив атом) или в ближайшей «поре» решетки. При этом образуются вакансии и дислоцированные атомы. Такие нарушения в порядке чередования атомов приводят к местным искажениям решетки. Накапливаясь, они могут привести к значительным искажениям кристаллической решетки. Например, трудно выстроить высокую башню из кубиков. Вначале постройка устойчива, но с каждым кубиком накапливаются
отклонения от требуемого положения и с какого-то кубика башня становится неустойчивой. Нечто подобнее можно ожидать и в кристаллической решетке. Простой расчет показывает, чтобы объяснить низкую реальную прочность металлов дефекты должны были бы занимать свыше 90% объема решетки. Металл превратился бы в настоящую губку. Это не соответствует действительности.
ВЫВОДЫ
1. Идеальный кристалл - это лишь модель кристаллической решётки,
не имеющая никаких нарушений строения.
2. При "жёстком сдвиге" кристалл обладает теоретической
прочностью порядка 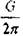
3. Реальная прочность кристаллов существенно ниже и находится на
уровне 
4. Присутствие точечных дефектов в кристаллической решетке не
позволяет объяснить несоответствие теоретической и реальной прочности
кристаллов.
ЛЕКЦИЯ 13 Раздел. Введение в теорию дефектов (продолжение)
План
1. Работы Френкеля Я.И.,Тейлора Дж.О, Орована Е., Поляни М.,
Коттрелла и Рида по теории дефектов.
2. Деформация - как эстафетный процесс разрыва межатомных
связей в кристалле.
3. Представление о линии дислокации как о границе сдвига.
4. Причины возникновения и плотность дислокаций.
5. Зависимость Одинга.
6. Классификация дефектов.
Ответ на вопрос несоответствия реальной и теоретической прочности кристаллов был получен не сразу. В 30-х годах нашего века независимо друг от друга наш соотечественник профессор Я.И. Френкель, зарубежные физики Дж, Тейлор, Е. Орован, М. Поляни предположили, что кристалл не разрушается сразу по плоскости сдвига. Процесс деформации постепенно распространяется в кристалле. В каждый момент времени только у небольшого числа атомов происходит разрыв связей. Затем такой локальный сдвиг, подобно волновому процессу, эстафетно от атома к атому перемещается через весь кристалл. Выигрыш в силе здесь происходит за счет увеличения времени сдвига. Так, велосипедист снижая скорость выигрывает в силе (мощности). При этом общая работа на участке остается неизменной (сила х скорость = работа/время = мощность). Поскольку реальные напряжения малы при сдвиге, то должен существовать какой-то концентратор, сосредотачивающий приложенное усилие в небольшой части кристалла.
Границу движущегося сдвига называют линией дислокации. Это нарушение - обрыв атомной плоскости в кристалле. Разорванная страница в тетради может иллюстрировать дислокацию; страницы - атомные плоскости, край разрыва страницы - аналог линии дислокации. Линия дислокации должна либо выходить на поверхность кристалла, либо быть замкнутой петлей (сдвиг внутри кристалла). Иначе будет разрыв сплошности кристалла. Характер поведения дислокационной линии под действием напряжений представлен нарис.13.1
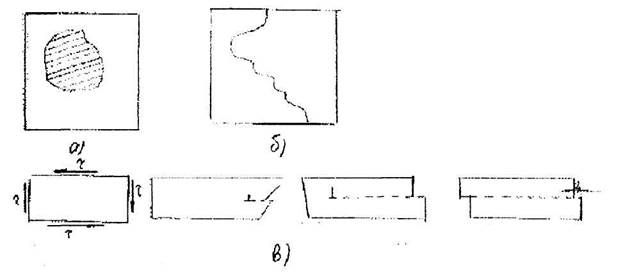
Рис. 13.1. Характер п<»едення дислокационной доний под действием напряжений
(здесь а - дислокационная петля (заштрихована область сдвига), б -вид смешанной дислокации, содержащей винтовые и краевые компоненты, выходящие на границы зерен или свободную поверхность кристалла, в -пробег краевой дислокации через весь кристалл с выходом на поверхность.
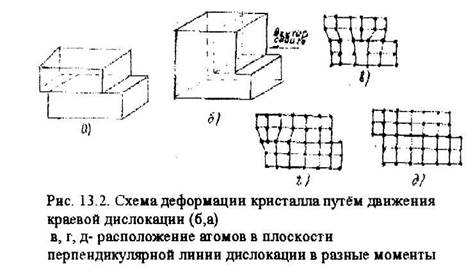
Дислокация, представляющая собой обрыв атомной плоскости, является концентратом напряжений. При сдвиге разрыв связей происходит не по всей плоскости скольжения, а только по линии дислокации. Это определяет низкие значения напряжений сдвига. На рис. 13.2,6,а представлена схема деформации кристалла путём движения краевой
дислокации. Расположение атомов в плоскости перпендикулярной линии дислокации в разные моменты времени показано на рис. 1З.2,в,г,д.
Дислокации в том или ином количестве всегда присутствуют в

|
| Рис. 13.3. Пространственная сетка дислокации в отожженном кристалле (сетка Франке) |
 кристаллах. Они возникают из-за напряжений роста, обусловленных температурным градиентом; на границе фронта кристаллизации, за счет конденсации вакансий; при кристаллизации на неровностях поверхности тигля; при наличии градиента концентраций и пр. При стабилизации структуры отжигом дислокации образуют 3-х мерную устойчивую дислокационную сетку Франка. На рис. 13.3 показана такая сетка наблюдаемая в отожженном кристалле.
кристаллах. Они возникают из-за напряжений роста, обусловленных температурным градиентом; на границе фронта кристаллизации, за счет конденсации вакансий; при кристаллизации на неровностях поверхности тигля; при наличии градиента концентраций и пр. При стабилизации структуры отжигом дислокации образуют 3-х мерную устойчивую дислокационную сетку Франка. На рис. 13.3 показана такая сетка наблюдаемая в отожженном кристалле.
В узлах сетки встречаются 3 или более дислокации. Наиболее устойчив узел из 3-х дислокаций. Когда энергии 3-х дислокаций равны, то внутренний угол встречи дислокационных линий равен 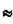 120°.
120°.
Наряду с сетками могут существовать как отдельные дислокации, так и дислокационные сплетения - клубки (при сложном взаимодействии дислокаций и точечных дефектов). Так, введенное первоначально чисто гипотически представление о дислокациях как линейных дефектах, позволило преодолеть трудности в понимании несоответствия теоретически реальной прочности кристаллов. Теория дислокации позволяет объяснить различный ход кривой деформации для кристаллов разной симметрии, понять протекающие в сплавах процессы при воздействии нагрузок, температур, облучения частицами высоких энергий, лазерной обработке и др.
Достаточно сказать, что все без исключения физические и механике свойства металлов зависят в той или иной степени от дефектной структуры металла. Изучая структуру и научившись управлять ею, мы получим возможность прогнозировать свойства и создавать новые материалы с заданными свойствами.
Только в 50-х годах, с развитием трансмиссионной электронной микроскопии, удалось непосредственно наблюдать дислокации.
Важной характеристикой дислокационной структуры является плотность дислокаций 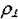 - суммарная длинавсех линий дислокации в 1 см3
- суммарная длинавсех линий дислокации в 1 см3
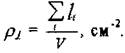
Таким образом, 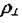 можно понимать как число дислокаций, пересекающих единицу площади поверхности кристалла. Плотность дислокаций зависит от состояния материала и вида его обработки. В металле действуют механизмы, приводящие к повышению
можно понимать как число дислокаций, пересекающих единицу площади поверхности кристалла. Плотность дислокаций зависит от состояния материала и вида его обработки. В металле действуют механизмы, приводящие к повышению 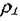 при
при
деформации, фазовом наклёпе, лазерной обработке и пр. В таблице 13.1 приводятся значения плотности дислокаций для разных состояний материала.
Date: 2015-09-24; view: 867; Нарушение авторских прав