
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Для элементарной стадии, где реагентами являются произвольные вещества А и В и которая описывается химическим уравнением со стехиометрическими коэффициентами а и Ь
|
|
аА + ЬВ → Продукты реакции
закон действующих масс можно описать следующим образом:
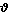 = kca(A)cb(B)
= kca(A)cb(B)
Коэффициент пропорциональности k называют константой скорости химической реакции. Константа скорости численно равна скорости реакции, если концентрации всех реагирующих веществ равны 1 моль/л, и зависит от природы реагирующих веществ, температуры и присутствия катализатора.
и
Для обратимой химической реакции, которую в общем виде можно изобразить уравнением
аА + bВ ↔ dD + gG
закон действующих масс можно математически описать следующим образом:
K=([D]d[G]g)/([A]a[B]b)
Где К — константа равновесия; [D], [G] — равновесные концентрации продуктов реакции; d, g — их стехиометрические коэффициенты; [А], [В] — равновесные концентрации реагентов; а, Ь -их стехиометрические коэффициенты.
для описания поведения растворов сильных электролитов, нужно эти уравнения преобразовать таким образом, чтобы учитывались зависимости констант равновесия и скоростей реакций не только от концентраций, но и от сил межионного и ион-дипольного взаимодействий. Однако общая теория растворов, которая позволяла бы теоретически учесть все виды внутренних взаимодействий в растворах при любых концентрациях, пока еще не создана. Поэтому был выбран другой путь: в указанных выражениях концентрации заменены активностями.
Активность молекул или ионов — это их эффективная концентрация, в соответствии с которой молекулы или ионы проявляют себя в химических и физических процессах.*
Значения активностей должны быть такими, чтобы при их подстановке сохранялась справедливость закона действующих масс. После замены концентраций активностями уравнение для скорости реакции принимает вид
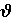 = kaaAabB
= kaaAabB
где 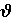 — скорость реакции; k — константа скорости реакции; аА и аB — активности реагентов А и В.
— скорость реакции; k — константа скорости реакции; аА и аB — активности реагентов А и В.
После такой же замены уравнение для константы равновесия принимает вид
K=(aDdaGg)/(aAaaBb)
К -- константа равновесия; аA, аB и аD, аG — активности реагентов и продуктов реакции.
Связь между концентрацией с и активностью а осуществляется с помощью коэффициента активности f.
а = fс.
Следует отметить, что ни активность, ни коэффициент активности не раскрывают сути сложных взаимодействий в растворах и их используют лишь для того, чтобы сохранить простую, удобную и привычную форму записи выражений закона действующих масс и ряда других важных закономерностей.
В настоящее время теоретический расчет коэффициентов активности возможен только для очень разбавленных растворов, где преобладает наиболее простой тип электростатического взаимодействия между ионами. Для концентрированных растворов, имеющих концентрации, используемые на практике, определение коэффициентов активности производится экспериментально.
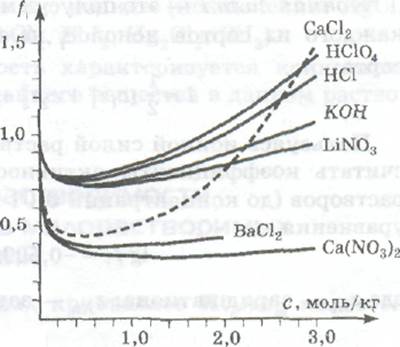
Зависимость коэффициентов активности некоторых сильных электролитов от концентрации их растворов.
Зависимости коэффициентов активности некоторых сильных электролитов от концентраций их растворов изображены и на рис, из которого видно, что в области очень малых концентраций (меньше 0,01 моль/кг Н20) коэффициенты активности всех электролитов стремятся к единице. С ростом концентрации они уменьшаются и при концентрациях от 0,1 до 1 моль/кг Н2О имеют минимальные значения. В области высоких концентраций коэффициенты активности снова увеличиваются.
Из рис. также видно, что характер зависимости f от концентрации сильно различается для одно-однозарядных электролитов типа НСl, КОН, НСl04, LiNО3, диссоциирующих с образованием однозарядного катиона и однозарядного аниона, и двух-однозарядных электролитов типа СаСl2, Са(NО3)2, ВаСl2. диссоциирующих с образованием двухзарядного катиона и двух однозарядных анионов. При одинаковых концентрациях электролитов в растворах коэффициенты активности всех одно-однозарядных электролитов имеют почти равные числовые значения, если концентрации не превышают 0,1 моль/кг Н2О. Коэффициенты активности двух-однозарядных электролитов в этих условиях заметно отличаются от f одно-однозарядных электролитов, но близки между собой. Из этого можно заключить, что для расчета коэффициентов активности в качестве характеристики раствора нужно пользоваться не концентрацией электролита в растворе, а другой величиной, отражающей концентрации всех сортов ионов в растворе и их заряды. Такой характеристикой является ионная сила раствора.
Date: 2015-09-18; view: 719; Нарушение авторских прав