
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Sрастворения>0
|
|
РАСТВОРЫ.
ПРИЧИНЫ ОБРАЗОВАНИЯ И СОСТАВ
Причины образования растворов
Раствор — это термодинамически устойчивая гомогенная система переменного состава, образованная двумя или более индивидуальными веществами.
Растворы бывают газовые, жидкие и твердые. В химии и биологии чаще всего приходится иметь дело с жидкими растворами, а из них самыми распространенными являются водные растворы.
В жидких растворах принято различать растворитель и растворенное вещество. Растворителем чаще всего называют тот компонент раствора, которого больше. В растворителе равномерно распределяются молекулы или ионы растворенного вещества.
Термодинамика растворения. При образовании истинных растворов происходит уменьшение энергии Гиббса:
Gрастворения<0
Если имеет место сильное взаимодействие частиц растворяемого вещества и растворителя, то процесс растворения экзотермический, т. е. сопровождается выделением теплоты:
H растворения<0
В этом случае в соответствии с уравнением
ΔG растворения = ΔH растворения - TΔS растворения
изменение энтропии ΔS растворения может быть как положительной, так и отрицательной величиной. Более вероятны процессы, в которых энтропия возрастает:
Sрастворения>0
но при растворении возможно и уменьшение энтропии (ΔS растворения< 0), если взаимодействующие между собой части цы растворенного вещества и растворителя образуют упорядоченные структуры.
Если же процесс растворения является эндотермическим (ΔHрастворения > 0), то самопроизвольно такой процесс может протекать только в результате роста энтропии (ΔSрастворения > 0). В этом случае имеет место слабое взаимодействие частиц растворенного вещества и растворителя.
Взаимодействие частиц в растворах. Между частицами растворителя и растворяемого вещества действуют физические и химические силы, обусловливающие образование растворов.
Физические силы, или силы Ван-дер-Ваальса. Они не вызывают разрыва и образования новых химических связей. По своей природе это кулоновские силы, т. е. силы притяжения между разноименными зарядами и силы отталкивания между одноименными зарядами разных молекул. Ван-дер-ваальсовы силы принято разделять на электростатические, поляризационные и дисперсионные.
Электростатические силы (их также иногда называют ориентационными силами или диполь-дипольным взаимодействием) возникают между молекулами с постоянными электрическими дипольными моментами, т. е. между молекулами, у которых есть положительный и отрицательный полюса. Электростатические силы стремятся расположить молекулы упорядоченно так, чтобы векторы электрических дипольных моментов были ориентированы вдоль одной прямой (рис. 6.1). Такое взаимное расположение диполей энергетически выгодно. Электростатические силы преобладают в растворах полярных веществ в полярных растворителях, например триметиламина N(СН3)3 в диметиловом эфире (СН3)2О.
Поляризационные силы, которые называют также индукционными, возникают в результате деформации (растяжения) электронной оболочки молекулы неполярного растворяемого вещества под действием электрического поля молекул сильно полярного растворителя (рис. 6.2). В результате такой деформации молекула растворяемого вещества приобретает дипольный момент (его называют наведенным или индуцированным), возрастают силы
притяжения между этой молекулой и молекулами растворителя, а энергия системы понижается, Поляризационные силы всегда гораздо слабее электростатических.
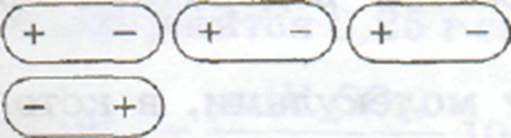
Рис. 6.1. Упорядоченное расположение молекул под действием электростатических сил: стрелками показаны направления постоянных дипольных моментов молекул
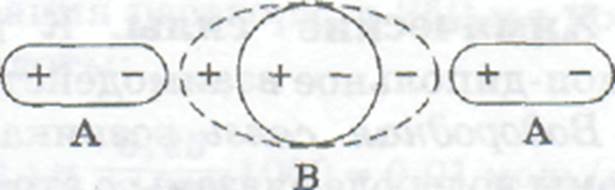
Рис. 6.2. Возникновение наведенного дипольного момента в неполярной молекуле В под действием электрического поля полярных молекул растворителя А
Дисперсионные силы возникают в результате согласования движения электронов в атомах двух соседних молекул (рис. 6,3).
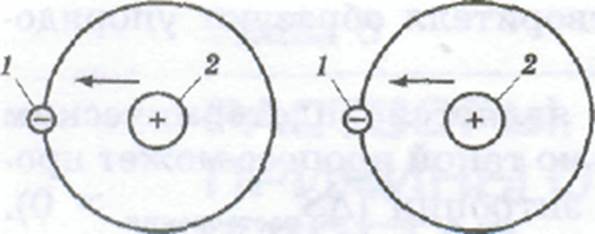
Рис.6.3. Схема взаимодействия согласующихся мгновенных электрических дипольных моментов (показаны стрелками) атомов соседних молекул: 1 – электроны, 2 – ядра атомов.
Так как любой из электронов атома всегда удален от ядра, его отрицательный заряд и положительный заряд ядра всегда образуют диполь, положение и взаимодействие которого с другими мгновенными диполями очень быстро изменяются во времени. При согласованном движении электронов среднее расстояние между ними в каждый данный момент времени немного увеличивается, в результате чего уменьшается их взаимное отталкивание и увеличивается притяжение между электроном одного атома и ядром другого атома, т. е. происходит взаимное притяжение молекул, в результате которого энергия системы уменьшается. Дисперсионные силы действуют между любыми молекулами, как полярными, так и неполярными. Однако они намного слабее электростатических сил, которые преобладают в растворах полярных веществ в полярных растворителях. Действием дисперсионных сил объясняется существование растворов неполярных веществ в неполярных растворителях. Примерами таких растворов являются нефть и жидкий воздух.
Энергия взаимодействий, обусловленных силами Ван-дер-Ваальса, намного меньше, чем энергии химических связей. Тем не менее силы Ван-дер-Ваальса играют важную роль в природе.
Химические силы. К ним относятся водородная связь и ион-дипольное взаимодействие.
Водородная связь возникает между молекулами, в которых атомы водорода связаны с атомами фтора, кислорода и азота. Она характерна для молекул фтороводорода НF, воды Н2О, аммиака NН3, карбоновых кислот, спиртов, аминокислот и cахаров.
Ион-дипольное взаимодействие — это электростатическое взаимодействие заряженного иона с молекулой полярного растворителя. В электрическом поле иона молекула ориентируется по отношению к нему за счет притяжения разноименных зарядов иона и одного из полюсов диполя (рис. 6.4).
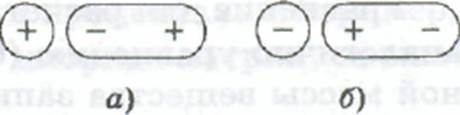
Рис.6.4. Ориентация полярной молекулы растворителя в электрическом поле катиона (а) и аниона (б)
Если с диполем растворителя взаимодействует крупный ион с небольшим зарядом, например К+ или Cl-, то энергия системы уменьшается незначительно: на 20— 60 кДж/моль. Полярная молекула растворителя при этом деформируется не очень сильно. Химическая связь в этом случае не возникает.
Если же ион мал и имеет кратный заряд (Са2+, Аl3+), то энергия системы «ион — диполь» уменьшается на 80—800 кДж/моль. При этом молекула растворителя деформируется настолько сильно, что электроны в значительной степени уходят от нее к иону и образуется химическая связь.
Ион-дипольное взаимодействие проявляется при растворении электролитов в полярных растворителях. Например, при растворении солей, кислот и оснований в воде, жидком аммиаке, спиртах и других сильно полярных растворителях.
Date: 2015-09-18; view: 1165; Нарушение авторских прав