
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гидратация — взаимодействие веществ с молекулами воды
|
|
Она обусловлена диполь-дипольным, ион-дипольным взаимодействием, образованием координационных и реже водородных связей.
В результате гидратации образуются гидратированные ионы.
Различают слабую и сильную гидратацию. Слабая гидратация- свойственна малозарядным ионам (катионам и анионам) с большим радиусом. В случае слабой гидратации ионы только ориентируют диполи воды, ориентация не превращается в химическую связь, число ориентированных молекул воды постоянно меняется, диполи воды быстро выходят из контакта с ионом, замещаются другими и имеют малое время жизни в гидратной оболочке. Энергия Гиббса слабой гидратации невелика (табл.).
Сильная гидратация характерна для многозарядных катионов с малым радиусом и проявляется в образовании двух гидратных оболочек (нарисовать рис.). В первичной оболочке, которая на рисунке заключена внутри пунктирной линии, ориентация диполей воды перерастает в химическую связь. Время жизни молекул воды в ней может достигать нескольких часов. Во вторич ной гидратной оболочке молекулы воды так же, как при слабой гидратации, только ориентированы относительно первичной гидратной оболочки, которую можно рассматривать как крупный катион (аквакатион). Время жизни молекул во вторичной гидратной оболочке составляет доли секунды.
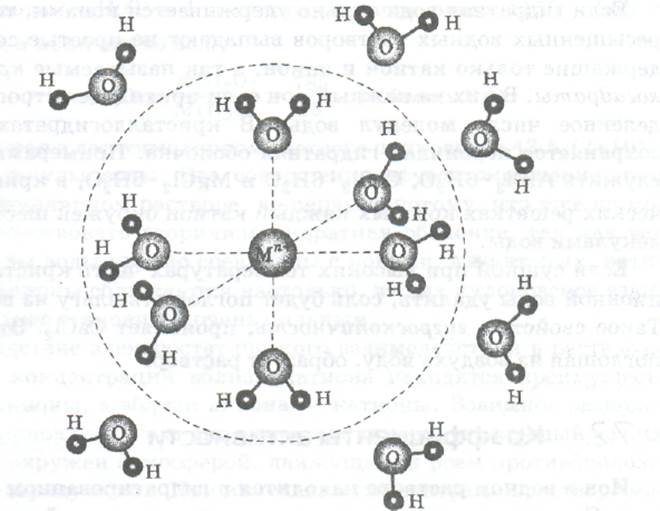
Рис. Строение гидратированного катиона при сильной гидратации
В целом сильная гидратация сопровождается большими изменениями энергии Гиббса (см. табл.).
Сравнение характеристик сильно и слабогидратированных ионов
| Характеристика | Слабогидратированные ионы | Сильногидратированные ионы | ||
| Nа+ | К+ | Al 3+ | Cr 3+ | |
| Радиус иона в кристаллах, nм (1 nм = 10-12 м) | 67,5 | 75,5 | ||
| Среднее время жизни молекулы воды в гидратной оболочке,с | 1,2 10-9 | 8,0 10-10 | 0,5 | часы |
| ΔGгидратации, кДж/моль | -406 | -331 | -4570 | -4380 |
Если гидратная вода сильно удерживается ионами, то из пересыщенных водных растворов выпадают не простые соли, содержащие только катион и анион, а так называемые кристаллогидраты. В них на каждый ион соли приходится строго определенное число молекул воды. В кристаллогидратах часто сохраняется первичная гидратная оболочка. Примерами могут служить АlCl3 • 6Н2О, СrCl3 • 6Н2О и МgCl2 • 6Н2О, в кристаллических решетках которых каждый катион окружен шестью молекулами воды.
Если сушкой при высоких температурах часть кристаллизационной воды удалить, соль будет поглощать влагу из воздуха. Такое свойство, гигроскопичность, проявляет СаСl2. Эта соль, поглощая из воздуха воду, образует раствор.
Date: 2015-09-18; view: 2103; Нарушение авторских прав