
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные сведения из термодинамики
|
|
Первое начало термодинамики представляет собой частную форму применительно к тепловым процессам всеобщего закона природы - закона превращения и сохранения энергии. Для квазистатических процессов он формулируется следующим образом: подведенное к единице массы газа бесконечно малое количество тепла 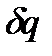 расходуется на повышение внутренней энергии газа
расходуется на повышение внутренней энергии газа 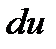 и на выполнение термодинамической работы
и на выполнение термодинамической работы
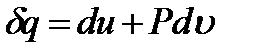 (1.8)
(1.8)
где 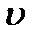 - удельный объем, определяемый по формуле (1.2).
- удельный объем, определяемый по формуле (1.2).
Формальное интегрирование выражения (1.8) позволяет найти полное количество тепла, которое подведено к газу в процессе изменения его состояния от начального 1 до конечного 2.
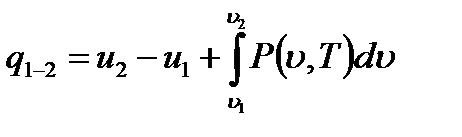 (1.9)
(1.9)
Интеграл, стоящий в правой части равенства (1.9), представляет работу термодинамического процесса расширения и зависит от характера процесса, т.е. вида кривой, соединяющей точки 1 и 2 на поверхности 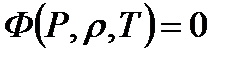 . Это указывает на то, что
. Это указывает на то, что 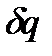 , входящее в равенство (1.8), не является полным дифференциалом. Однако, если обе части равенства (1.8) умножить на интегрирующий множитель
, входящее в равенство (1.8), не является полным дифференциалом. Однако, если обе части равенства (1.8) умножить на интегрирующий множитель 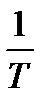 , то выражение
, то выражение 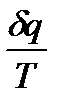 становится полным дифференциалом некоторой функции состояния
становится полным дифференциалом некоторой функции состояния 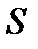 , называемой энтропией, т.е.
, называемой энтропией, т.е.
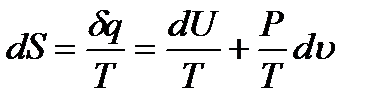 (1.10)
(1.10)
При переходе газа из состояния 1 в состояние 2 изменение 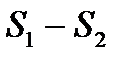 не зависит от характера процесса перехода, а целиком и полностью определяется начальным и конечным состояниями.
не зависит от характера процесса перехода, а целиком и полностью определяется начальным и конечным состояниями.
Следует обратить внимание, что равенство (1.10) справедливо для обратимых процессов. Обратимым называется процесс изменения состояния, который, будучи переведен в обратном направлении, возвращает систему в первоначальное состояние через те же промежуточные состояния без каких- либо изменений в окружающей среде.
Необратимые процессы изменения состояния определяются условием
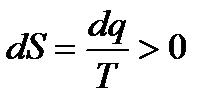 (1.11)
(1.11)
Неравенство (1.11) является математическим выражением второго начала термодинамики, которое характеризует направление протекающих в природе макроскопических процессов. Второе начало термодинамики позволяет установить количественное соотношение между работой, которая могла бы быть совершена системой при обратимом процессе, и действительной работой.
При изучении закономерностей движения газа необходимо учитывать термодинамический процесс изменения состояния газа. При этом различают изотермический, адиабатный, изоэнтропийный, изоэнтальпийный процессы.
Процесс, происходящий без теплообмена системы с окружающей средой, называется адиабатным. Процесс в системе, при котором сохраняется неизменной энтропия системы, называется изоэнтропийным. Изоэнтропийный процесс - это не что иное как обратимый адиабатный процесс. Он возможен в энергетически изолированной системе при отсутствии трения между частицами газа. При наличии трения между частицами газа адиабатный процесс будет неизоэнтропийным. Выделяющееся внутри системы тепло, обусловленное работой сил трения приводит к возрастанию энтропии 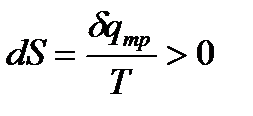 и, конечно, процесс при этом будет необратимым.
и, конечно, процесс при этом будет необратимым.
Процесс в системе, характеризуемый постоянством энтальпии, называется изоэнтальпийным.
Энтальпией (теплосодержанием), отнесенной к единице массы, называется функция
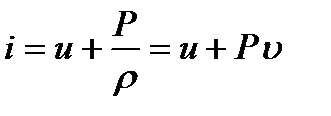 (1.12)
(1.12)
которая определяется только состоянием газа, например, температурой и давлением.
Рассмотрим основные соотношения термодинамических параметров для идеального газа, которые будут использоваться в дальнейшем при изложении курса.
Подведенное к системе тепло 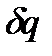 приведет к новому состоянию газа с параметрами
приведет к новому состоянию газа с параметрами 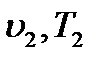 . Количество подведенного тепла
. Количество подведенного тепла 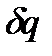 можно выразить через удельную теплоемкость газа при постоянном давлении
можно выразить через удельную теплоемкость газа при постоянном давлении 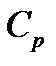

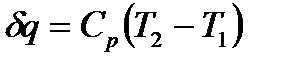 (1.13)
(1.13)
С другой стороны, согласно первому началу термодинамики подведенное тепло идет на изменение внутренней энергии газа, которое в соответствии с (1.5) равно 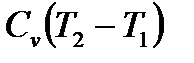 , и на выполнение работы расширения газа
, и на выполнение работы расширения газа 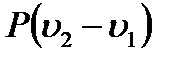 . Следовательно,
. Следовательно,
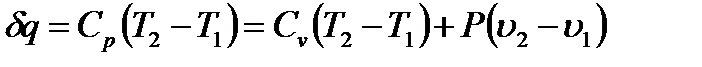 (1.14)
(1.14)
Второе слагаемое в правой части равенства (1.14) можно преобразовать, используя уравнение состояния (1.3), к виду
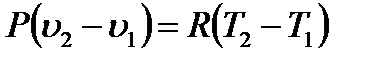 (1.15)
(1.15)
Если теперь заменить второе слагаемое в (1.14) по формуле (1.15), то после сокращения на величину 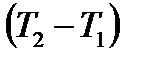 получим известное в термодинамике выражение Майера
получим известное в термодинамике выражение Майера
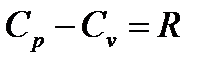 (1.16)
(1.16)
Используя соотношения (1.3), (1.5) и (1.16), можно получить иные выражения для энтальпии 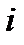 . В самом деле, из (1.12) имеем
. В самом деле, из (1.12) имеем
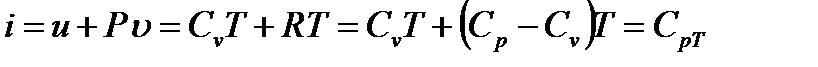 (1.17)
(1.17)
Последнее выражение предстанет в ином виде, если в нем заменить 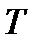 по формуле (1.3)
по формуле (1.3)
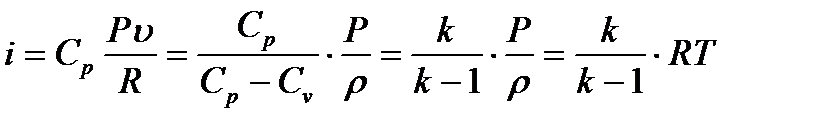 (1.18)
(1.18)
где 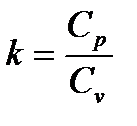 (1.19)
(1.19)
Изменение энтропии 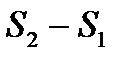 при переходе идеального газа из состояния 1 в состояние 2 определится интегрированием (1.10), которое с учетом выражений (1.5) и (1.3) дает
при переходе идеального газа из состояния 1 в состояние 2 определится интегрированием (1.10), которое с учетом выражений (1.5) и (1.3) дает
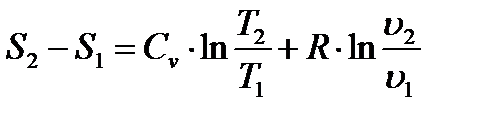
или, если использовать формулу Майера (1.16)
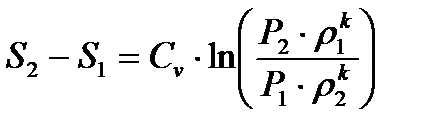 (1.20)
(1.20)
Используя (1.20), получается уравнение адиабаты Пуассона, описывающее изоэнтропийный (обратимый адиабатный) процесс изменения состояния газа 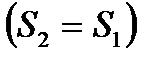
 (1.21)
(1.21)
Показатель степени 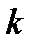 , входящий в (1.21) и определяемый формулой (1.19), называется показателем адиабаты Пуассона.
, входящий в (1.21) и определяемый формулой (1.19), называется показателем адиабаты Пуассона.
2. ОСНОВНЫЕ ЗАКОНЫ СЖИМАЕМОЙ СРЕДЫ
Date: 2015-08-15; view: 608; Нарушение авторских прав