
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные свойства газа
|
|
Изложение данного курса основано на представлении газа как сплошной сжимаемой среды. Среда называется сплошной, если имеет достаточно большое число молекул в бесконечно малом объеме занимаемого пространства. Это позволяет рассматривать такие параметры, как плотность газа, давление, скорость и температуру как непрерывные функции координат и, следовательно, широко применять аппарат математического анализа.
Термодинамическое состояние газа определяется тремя величинами: давлением  , плотностью
, плотностью  и температурой
и температурой 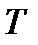 . Все эти параметры взаимосвязаны. Изменение какой-либо из этих величин приводит в общем случае к изменению остальных. Математическая зависимость указанных параметров называется уравнением состояния сжимаемой среды
. Все эти параметры взаимосвязаны. Изменение какой-либо из этих величин приводит в общем случае к изменению остальных. Математическая зависимость указанных параметров называется уравнением состояния сжимаемой среды
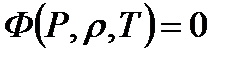 (1.1)
(1.1)
Иногда вместо плотности газа вводят понятие удельного объема  , представляющего собой величину, обратную плотности, т.е.
, представляющего собой величину, обратную плотности, т.е.
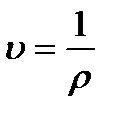 (1.2)
(1.2)
В термодинамике в качестве уравнения состояния газа широко используется уравнение Клапейрона-Менделеева
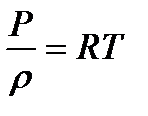 (1.3)
(1.3)
где 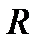 - газовая постоянная (для каждого газа своя), Дж/(кг
- газовая постоянная (для каждого газа своя), Дж/(кг  К). Значение
К). Значение 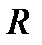 для каждого газа можно вычислить, если известна его молекулярная масса
для каждого газа можно вычислить, если известна его молекулярная масса 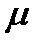 (кмоль/кг), по формуле:
(кмоль/кг), по формуле:
 (1.4)
(1.4)
где  - универсальная газовая постоянная,
- универсальная газовая постоянная,  Дж/(кмоль
Дж/(кмоль 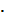 К).
К).
Уравнение состояния (1.3) получено теоретически для модели идеального газа, т.е. газа, в котором отсутствуют силы притяжения между молекулами и изменение внутренней энергии 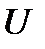 связано только с изменением его абсолютной температуры
связано только с изменением его абсолютной температуры 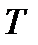 . Для единицы массы газа это изменение определяется по формуле:
. Для единицы массы газа это изменение определяется по формуле:
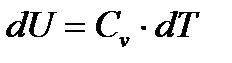 (1.5)
(1.5)
где  - удельная теплоемкость газа при постоянном объеме, Дж/(кг
- удельная теплоемкость газа при постоянном объеме, Дж/(кг  К).
К).
Для реальных сжимаемых сред внутренняя энергия 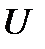 зависит не только от температуры, но и от давления, и соотношение (1.5) теряет силу.
зависит не только от температуры, но и от давления, и соотношение (1.5) теряет силу.
Именно поэтому газ, подчиняющийся уравнению вида (1.3), называют идеальным (в специальной литературе по газовой динамике такой газ называют еще совершенным). В газодинамике вводят также понятие идеальный газ в смысле невязкий (по аналогии с моделью идеальной жидкости), т.е. газ, у которого отсутствуют силы внутреннего трения. Поэтому, когда используется этот термин, необходимо четко различать какая из этих моделей имеется в виду.
Во избежание путаницы будем в дальнейшем пользоваться первым определением идеального газа, различая при этом отдельно случаи невязкого и вязкого газа.
Реальные газы, в общем случае, не следуют закону Клапейрона-Менделеева. Это уравнение с достаточной точностью может быть применено для реальных газов только в узком диапазоне изменения температуры и давления. Причем этот диапазон для каждого газа свой.
В настоящее время предложено множество эмпирических и полуэмпирических уравнений состояния для реальных газов. Наиболее известные из них - это уравнение Ван дер Ваальса и нижеследующее уравнение
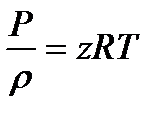 (1.6)
(1.6)
которое широко применяется в большинстве задач нефтяной и газовой отраслях промышленности.
В уравнении (1.6) 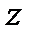 - коэффициент, учитывающий степень отклонения реального газа от идеального (совершенного), принимает значение меньшее, равное и большее единицы. Иногда
- коэффициент, учитывающий степень отклонения реального газа от идеального (совершенного), принимает значение меньшее, равное и большее единицы. Иногда 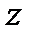 называют коэффициентом сжимаемости или сверхсжимаемости. Коэффициент
называют коэффициентом сжимаемости или сверхсжимаемости. Коэффициент 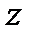 , вообще говоря, является функцией давления
, вообще говоря, является функцией давления  и температуры
и температуры 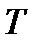 . Для нахождения численных значений
. Для нахождения численных значений 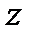 можно рекомендовать обобщенные графики, на которых
можно рекомендовать обобщенные графики, на которых 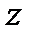 представлен в зависимости от приведенных значений давления
представлен в зависимости от приведенных значений давления 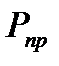 и температуры
и температуры 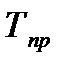
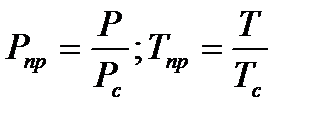 (1.7)
(1.7)
где 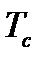 и
и  - критические температура и давление, являющиеся физико-химическими характеристиками газа.
- критические температура и давление, являющиеся физико-химическими характеристиками газа.
Известно, что изменяя  и
и  можно осуществлять фазовый переход вещества из газообразного в жидкое состояние, но не всегда.
можно осуществлять фазовый переход вещества из газообразного в жидкое состояние, но не всегда.
Критическая температура - это температура, выше которой газ невозможно перевести в жидкое состояние никаким (сколь угодно большим) повышением давления, т.е. при 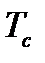 газ еще можно обратить в жидкость. Минимальное давление, которое обеспечивает переход из газообразного состояния в жидкое при
газ еще можно обратить в жидкость. Минимальное давление, которое обеспечивает переход из газообразного состояния в жидкое при 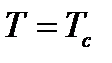 , называется критическим
, называется критическим 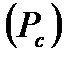 .
.
Для каждого индивидуального (чистого) газа значение 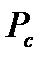 и
и 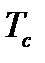 можно найти в специальной литературе по добыче, транспорту и переработке природного и нефтяного газа. Для газовых смесей вводятся понятия псевдокритических значений давления и температуры, определяемых через
можно найти в специальной литературе по добыче, транспорту и переработке природного и нефтяного газа. Для газовых смесей вводятся понятия псевдокритических значений давления и температуры, определяемых через 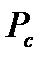 и
и 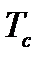 входных в смесь компонентов как средневзвешенные значения.
входных в смесь компонентов как средневзвешенные значения.
Date: 2015-08-15; view: 540; Нарушение авторских прав