
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Типы связей в атомах. Мультиплетное расщепление термов
|
|
Свойства атома зависят от того, как происходит образование полного момента атома. Существует два способа вычисления полного момента многоэлектронного атома.
1. Орбитальный момент каждого электрона складывается со спиновым моментом этого электрона, образуя полный момент электрона 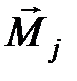 . После этого полные моменты различных электронов атома складываются, образуя полный момент атома
. После этого полные моменты различных электронов атома складываются, образуя полный момент атома 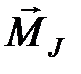 . Такая связь называется j- j -связь. Таким образом, при j-j -связи
. Такая связь называется j- j -связь. Таким образом, при j-j -связи 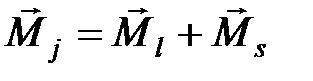 , а для атома
, а для атома 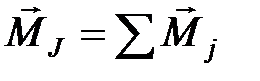 .
.
2. Орбитальные моменты различных электронов атома складываются друг с другом, образуя суммарный орбитальный момент атома 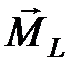 . Спины отдельных электронов складываются, образуя суммарный спиновый момент атома
. Спины отдельных электронов складываются, образуя суммарный спиновый момент атома 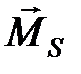 . После этого полный момент атома
. После этого полный момент атома 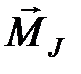 получается как сумма
получается как сумма 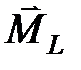 и
и 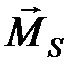 . Такая связь электронов в атоме называется L- S- связью. Эту связь можно представить следующим образом:
. Такая связь электронов в атоме называется L- S- связью. Эту связь можно представить следующим образом: 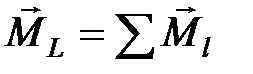 ,
, 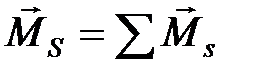 ,
, 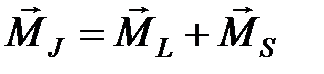 .
.
Реализация этих двух типов связей зависит от характера взаимодействия между электронами. Если энергия взаимодействия спина электрона с его магнитным моментом больше, чем энергия взаимодействия орбитального и спинового моментов электрона с другими электронами, то осуществляется
j- j -связь. Если же сила взаимодействия между спиновыми и орбитальными моментами всех электронов больше, чем сила взаимодействия между спиновым и орбитальным моментами каждого электрона, то осуществляется L-S -связь. Анализ экспериментального материала показывает, что в большинстве случаев хорошим приближением является L-S -связь. Поэтому в теории строения атомов эта связь играет главную роль.
В приближении L-S -связи полный спиновый магнитный момент атома взаимодействует с орбитальным движением всех электронов атома, описываемым полным орбитальным моментом атома, т.е. в атоме существует спин-орбитальное взаимодействие. Оно зависит от спинового и орбитального магнитного моментов и от их взаимной ориентировки. Число возможных ориентировок (мультиплетность) определяется 2 L +1, если L>S или 2 S +1, если S>L. Обычно 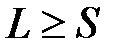 , поэтому мультиплетность оценивается как 2 S +1. Каждая взаимная ориентировка
, поэтому мультиплетность оценивается как 2 S +1. Каждая взаимная ориентировка 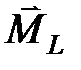 и
и 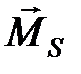 дает свою энергию взаимодействия, которая и обуславливает расщепление соответствующего энергетического уровня атома, т.е. мультиплетную структуру термов атома. Мультиплетность линий излучения порождается мультиплетностью энергетических уровней атома. При этом соблюдаются правила отбора для квантовых чисел орбитального, спинового и полного моментов:
дает свою энергию взаимодействия, которая и обуславливает расщепление соответствующего энергетического уровня атома, т.е. мультиплетную структуру термов атома. Мультиплетность линий излучения порождается мультиплетностью энергетических уровней атома. При этом соблюдаются правила отбора для квантовых чисел орбитального, спинового и полного моментов:  1;
1; 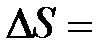 0;
0; 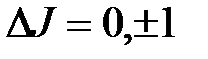 .
.
Глава IV. КВАНТОВАЯ ФИЗИКА МЕЖАТОМНОГО ВЗАИМОДЕЙСТВИЯ
4.1. Классификация типов связей
Несмотря на большое разнообразие химических элементов и великое множество их соединений в природе, существует сравнительно небольшое число различных типов связей между атомами и молекулами. В зависимости от постановки задач исследования их можно классифицировать по разным признакам, например, на химические и физические (по возможности образовывать или не образовывать химические соединения), локализованные и делокализованные (по количеству ионов или ядер, приходящихся на один электрон связи), гомеополярные и гетерополярные (в соответствии со свойствами симметрии электронного облака), межатомные и межмолекулярные (в основном, по энергии связи).
Обычно типы связей классифицируют по их различной физической природе, месту и роли, которые они играют в формировании структуры, а также химических и физических свойств вещества. В соответствии с этим различают ковалентную, ионную, металлическую, водородную связи и силы Ван-дер-Ваальса и некоторые другие, являющиеся частными случаями указанных.
Ковалентная связь возникает в результате туннелирования электрона от одного атома к другому через барьер сравнительно небольшой ширины (~ 1 нм) и высоты (~ 1 эВ), который образуется при сближении атомов.

Рис. 4.1. Образование ковалентной связи. а) гомеополярная связь А-А;
б) гетерополярная связь А-В. Uат - атомный потенциал, Uмол - потенциальная энергия электрона в молекуле, D Eсв - понижение энергии вследствие делокализации валентных электронов
Такой перенос заряда оказывается возможным, когда расстояние между ядрами атомов становится сопоставимым с размерами атомов. В результате туннелирования каждый валентный электрон обобществляется всей системой. Неопределенность его координаты D x возрастает и в соответствии с соотношением неопределенности Гейзенберга D x D p > 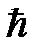 , неопределенность импульса D p, а следовательно, полная анергия Е ~(D р)2/2 m уменьшаются. Процесс, при котором возрастает неопределенность координаты частицы, называемый делокализацией, всегда энергетически выгоден и приводит к силам притяжения (Рис. 4.1).
, неопределенность импульса D p, а следовательно, полная анергия Е ~(D р)2/2 m уменьшаются. Процесс, при котором возрастает неопределенность координаты частицы, называемый делокализацией, всегда энергетически выгоден и приводит к силам притяжения (Рис. 4.1).
Если молекула образуется из одинаковых атомов (А-А), то в результате туннелирования валентных электронов образуется симметричное относительно ядер электронное облако. Такую ковалентную связь называют гомеополярной (Рис. 4.1а). Если молекула образуется из разных атомов (А-В) так, что энергетические уровни валентных электронов не совпадают E 1> E 2, то электронное облако молекулы оказывается несимметричным (Рис.4.1б). Это возникает благодаря тому, что вероятность туннелирования электрона от атома А к В оказывается выше вероятности обратного процесса - от В к А, который связан с преодолением более широкого барьера a 2> a 1 на большей глубине залегания уровня Е 2. Центр «тяжести» электронного облака смещается к атому В с меньшей анергией валентного электрона и молекула приобретает дипольный момент. Такую связь называют гетерополярной.
Помимо понижения энергии электронов при их делокализации (обобществлении) существует другая причина образования ковалентной связи, обусловленная обменным взаимодействием электронов, которое проявляет себя двояким образом. В гомеополярной молекуле система валентных электронов может находится в двух энергетических состояниях: синглетном, с антипараллельными спинами, и триплетном, с параллельными спинами, причем первое состояние энергетически более выгодно. Как правило, энергия, выделяемая при спаривании валентных электронов, оказывается выше энергии, выделяемой при делокализации электронов за счет туннелирования.
Обменное взаимодействие внутриатомных электронов наиболее интенсивно для электронов, принадлежащих одной электронной оболочке. Порядок ее заполнения электронами в соответствии с правилами Хунда отражает зависимость полной энергии оболочки от ее полного спина (внутриатомный обмен). Эта зависимость приводит к тому, что атомы с недостроенными оболочками стремятся присоединить к себе электрон, понизив при этом свою энергию на величину Э, называемую сродство к электрону. По отношению к образованию химической связи все атомы удобно различать по электроотрицательности Х= (I +Э)/2 (где I - потенциал ионизации атома), которая характеризует способность атомов «отбирать» электрон у «соседа по молекуле» для завершения своей электронной оболочки. Поэтому в гетерополярной молекуле степень асимметрии электронного облака и ее дипольный момент определяется разностью электроотрицательностей атомов (ХB - ХA) зачастую в большей степени, чем разностью энергий валентных электронов (E 2- E 1). Вещества и соединения с ковалентной связью являются, как правило, хорошими полупроводниками и диэлектриками (германий, кремний, алмаз и др.).
Ионная связь. Если электроотрицательности атомов сильно отличаются, т.е. XB  XA, то электронное облако сосредоточено, в основном, у атома В, что соответствует превращению его а анион (отрицательный ион). При этом атом А, отдавший электрон, превратится в катион (положительный ион). Электростатическое притяжение между анионом и катионом называют ионной связью. Ионная связь самая прочная в природе. Моделирование молекулы в виде связанных ионов ограничивается возможностью образования многозарядных анионов. Действительно, образование, например, двухзарядного аниона F2- невозможно из-за сил отталкивания между электронами и однозарядным анионом F1-. Поэтому наиболее типичными соединениями с ионной связь являются галоиды щелочных и щелочноземельных металлов (LiF, NaCl, BaCl2 т.д.), которые являются хорошими диэлектриками.
XA, то электронное облако сосредоточено, в основном, у атома В, что соответствует превращению его а анион (отрицательный ион). При этом атом А, отдавший электрон, превратится в катион (положительный ион). Электростатическое притяжение между анионом и катионом называют ионной связью. Ионная связь самая прочная в природе. Моделирование молекулы в виде связанных ионов ограничивается возможностью образования многозарядных анионов. Действительно, образование, например, двухзарядного аниона F2- невозможно из-за сил отталкивания между электронами и однозарядным анионом F1-. Поэтому наиболее типичными соединениями с ионной связь являются галоиды щелочных и щелочноземельных металлов (LiF, NaCl, BaCl2 т.д.), которые являются хорошими диэлектриками.
Металлическая связь возникает в результате обобществления внешних, слабо связанных, обычно s-электронов атомов в конденсированном состоянии. Валентные электроны теряют «родственные связи» со своими атомами и принадлежат всему металлу. Металлическая связь обусловлена, в основном, понижением энергии из-за сильной делокализации электронов, поэтому ее иногда называют ненасыщенной ковалентной связью. Металл можно рассматривать в виде решетки положительных ионов, «погруженной» в электронную жидкость коллективизированных электронов проводимости.
Водородная связь образуется между водородом и двумя электроотрицательными атомами (обычно N, О, F и др.). Из-за сильной разницы электроотрицательностей этих атомов и водорода последний теряет свой электрон, отдавая его для завершения электронной оболочки одного из атомов, поэтому водородную связь можно рассматривать как ионную связь на протоне или протонной связью. Водородная связь может быть как внутримолекулярной (например, в HF), так и межмолекулярной (как в воде и льде), являясь «мостиком» между различными участками сложных органических молекул, в том числе белков и нуклеиновых кислот. Водородная связь «отвечает» за многие уникальные свойства воды и льда, а так же некоторых сегнетоэлектриков.
Силы Ван-дер-Ваальса - силы притяжения между атомами и молекулами, которые не теряют своей индивидуальности в конденсированном состоянии, оставаясь нейтральными. Эти силы называют иногда «физическими», так как они не связаны с переносом заряда и не приводят к образованию химических соединений. Как правило, они обусловлены диполь-дипольным взаимодействием молекул, реже взаимодействием мультиполей более высоких порядков. Различают ориентационные силы (между полярными молекулами), индукционные силы (между полярной и неполярной молекулами) и дисперсионные силы или силы Лондона (между атомами или молекулами не обладающих дипольным, квадрупольным и пр. моментами). Последние имеют чисто квантовую природу и связаны с понижением энергии нулевых колебаний взаимодействующих атомных объектов. Силы Ван-дер-Ваальса «отвечают» за конденсацию газов, вязкость жидкостей, адгезию (сцепление поверхности твердых тел), сухое трение и пр.
Силы Казимира-Польдера действуют на расстояниях, значительно превышающих размеры атомов и молекул, и вызывают сжатие газов при охлаждении. Они отличаются от обычных дисперсионных сил учетом потенциалов запаздывания, возникающих на больших расстояниях из-за конечности скорости распространения электромагнитного взаимодействия между молекулами - скорости света.
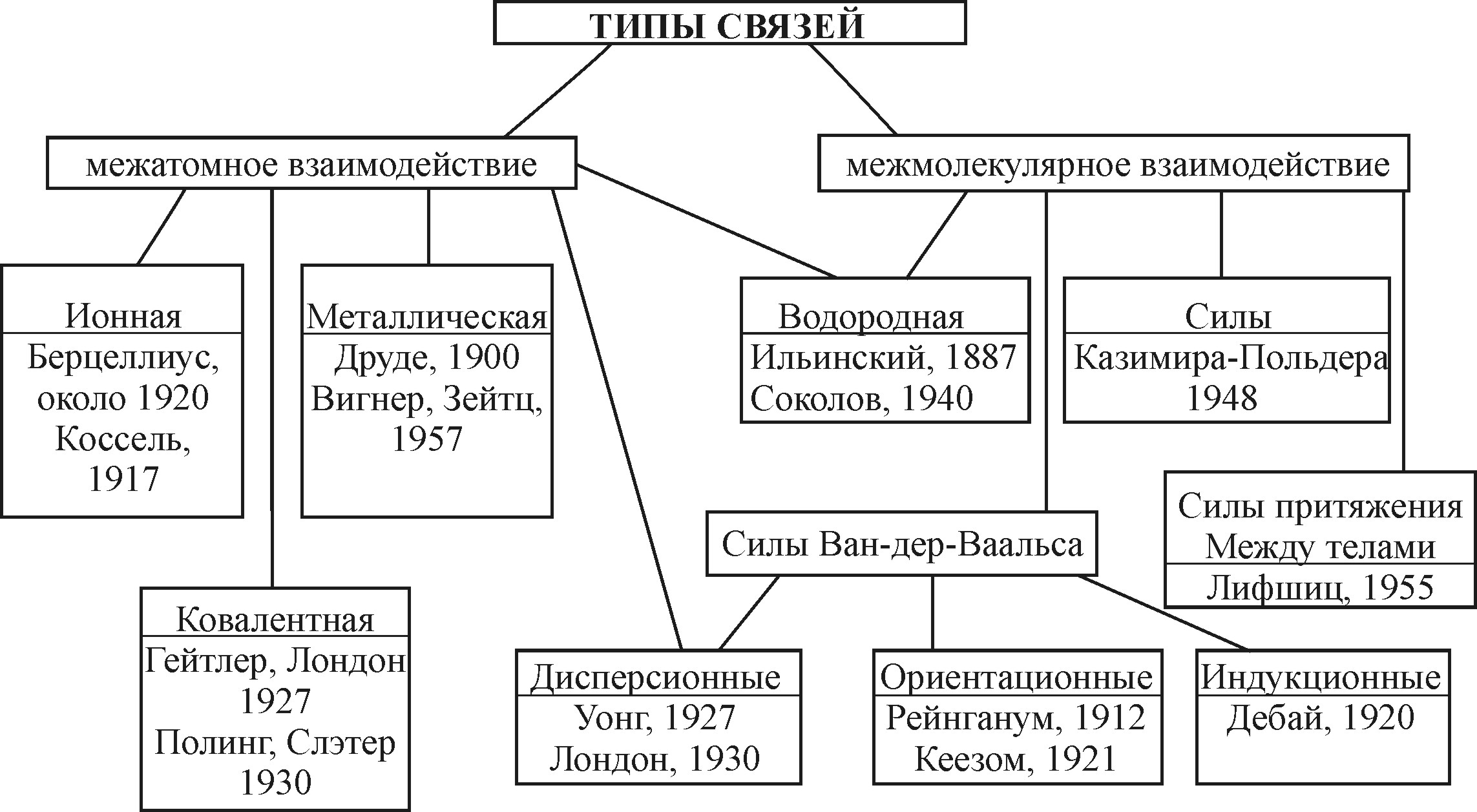
Рис. 4.2. Классификация типов связей. Первая фамилия, стоящая под названием типа связи, обозначает ссылку на первые модельные представления, а вторая - на общую теорию.
Силы притяжения между макротелами (силы Лифшица) обусловлены флуктуациями зарядовой плотности, что вызывает появления мгновенных мультипольных моментов разного порядка. Мультиполь-мультипольное взаимодействие приводит к притяжению тел. Существование молекул и твердых тел обусловлено тем, что перечисленные силы притяжения различной природы на расстояниях порядка межатомных уравновешиваются силами отталкивания, которые имеют единую природу, и обусловлены обменным взаимодействием электронов заполненных оболочек атомов, а также электростатическим отталкиванием положительных ядер.
На рис. 4.2 видно, что до создания квантовой механики в 1925-26 гг. физика могла количественно объяснить ионную связь, ориентационные и индукционные взаимодействия и лишь качественно водородную и металлическую связи. Квантовая механика позволила с единых позиции объяснить все типы связей, которые, как правило, имеют существенно квантовую природу и только в определенных предельных ситуациях могут быть оценены в соответствии с классической физикой.
Date: 2015-05-19; view: 3189; Нарушение авторских прав