
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Валентное состояние атома
|
|
При образовании химического соединения обычно происходит перестройка электронной оболочки атома, поэтому валентное, т.е. возбужденное состояние атома при вступлении его в химическую связь отличается от состояния изолированного атома. Например, атом азота имеет в основном состоянии три р - электрона с параллельными спинами, которые описываются соответственно сферическими функциями 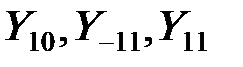 . Эти электроны имеют близкие значения энергии, поэтому в возбужденном состоянии, в соответствии с теорией возмущений в случае вырождения эти функции преобразуются в линейные комбинации вида:
. Эти электроны имеют близкие значения энергии, поэтому в возбужденном состоянии, в соответствии с теорией возмущений в случае вырождения эти функции преобразуются в линейные комбинации вида:
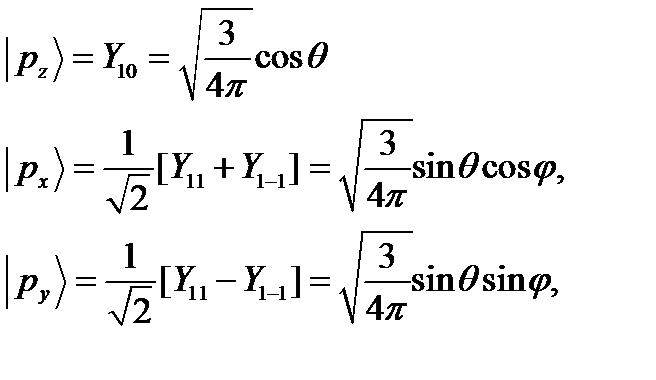 (16)
(16)
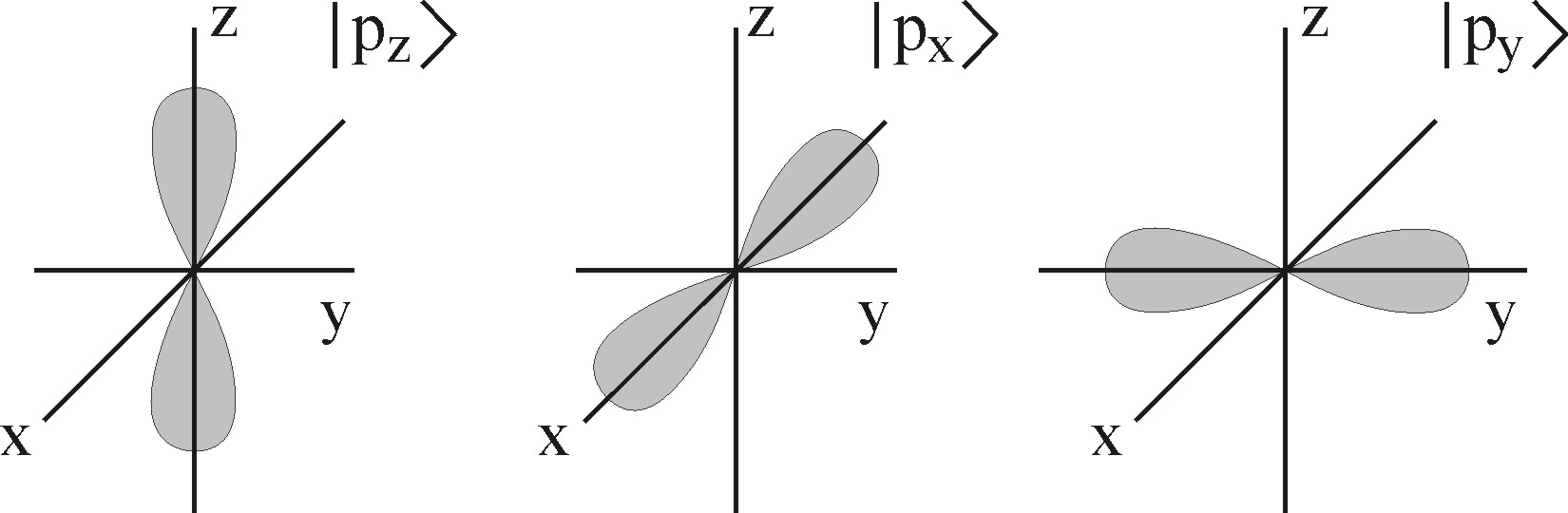
|
Рис. 4.10. Форма р -электронных орбиталей, соответствующих валентному
состоянию атома азота
которые имеют форму «гантелей», вытянутых вдоль направлений z, x, y соответственно.
Если мысленно соединить начала координат в этих рисунках, то мы получим картину валентного состояния атома азота. Очевидно, при образовании молекулы азота 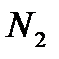 возможны связи двух типов: s-связь и p-связь (см. рис. 4.11), причем s-связь прочнее за счет большего перекрывания p -орбиталей. Поэтому в молекуле азота атомы связаны тройной связью, одной s-связью и двумя p-связями, т.е. N
возможны связи двух типов: s-связь и p-связь (см. рис. 4.11), причем s-связь прочнее за счет большего перекрывания p -орбиталей. Поэтому в молекуле азота атомы связаны тройной связью, одной s-связью и двумя p-связями, т.е. N  N.
N.
 s-связь
s-связь
|  p-связь
p-связь
|
Рис. 4.11. Образование s и p-связей
Принцип наибольшего перекрывания
Из задачи Гейтлера и Лондона следует, что энергия ковалентной связи определяется, в основном, значением обменного интеграла, который тем больше, чем больше перекрывается волновые функции соседних атомов. Отсюда следует, что электронная конфигурации молекул, соответствующая максимальному перекрыванию волновых функций валентных электронов с антипараллельными спинами энергетически наиболее выгодна и поэтому реализуется в природе. Это утверждение носит название принципа наибольшего перекрывания. Он лежит в основе квантохимической теории строения молекул, развитой Л.Полингом и Дж.Слэтером. Из принципа наибольшего перекрывания в частности следует, что при образовании химического соединения сначала образуются s-связи, а после их насыщения - p-связи, так как область перекрывания в первом случае больше, чем во-втором.
Гибридные состояния атомных орбиталей
При возбуждении атома, вступающего в химическую связь могут смешиваться не только состояния одной электронной оболочки, но и состояния различных оболочек, принадлежащих одному электронному слою с близкими значениями энергии. Такие состояния принято называть гибридными. Возможно, например, образование sp -, sp -, pd -гибридных орбиталей и пр. Идея гибридизации состояний была впервые предложена Слэтером и Полингом для объяснения валентности углерода, равной 4, которую он проявляет в ряде соединений, например, в молекуле метана 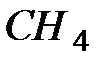 .
.
В качестве простого примера гибридизации рассмотрим валентное состояние атом 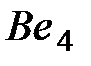 . Его электронные конфигурации в основном состоянии
. Его электронные конфигурации в основном состоянии 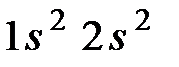 , а в возбужденном
, а в возбужденном 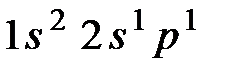 ; 2 s и 2 р состояния имеет близкие значения энергии, поэтому в соответствии теорией возмущения в случае 2-х кратного вырождения, валентное состояние внешних электронов выражаются формулами, аналогичными (10)
; 2 s и 2 р состояния имеет близкие значения энергии, поэтому в соответствии теорией возмущения в случае 2-х кратного вырождения, валентное состояние внешних электронов выражаются формулами, аналогичными (10)
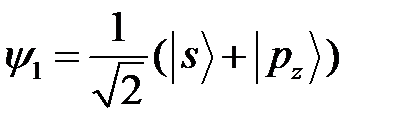 ;
; 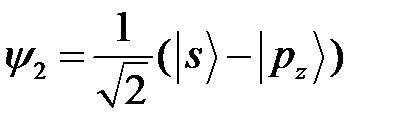 ,
,  (17)
(17)
Учитывая, что угловая часть основных состояний описывается сферическими функциями 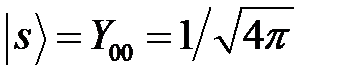 ;
; 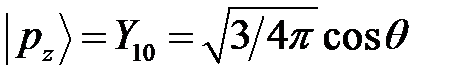 , получим:
, получим:
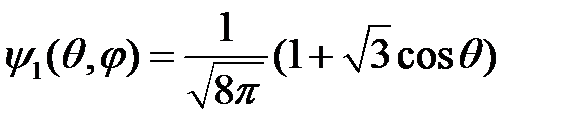 ;
; 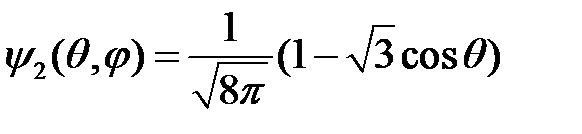 , (18)
, (18)
Функции 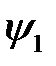 и
и  не зависят от угла
не зависят от угла  , поэтому sp -гибридные орбитали представляют собой тела вращения с осью z. Гибридизация объясняет, например, линейную структуру молекулы
, поэтому sp -гибридные орбитали представляют собой тела вращения с осью z. Гибридизация объясняет, например, линейную структуру молекулы 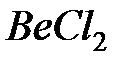 .
.
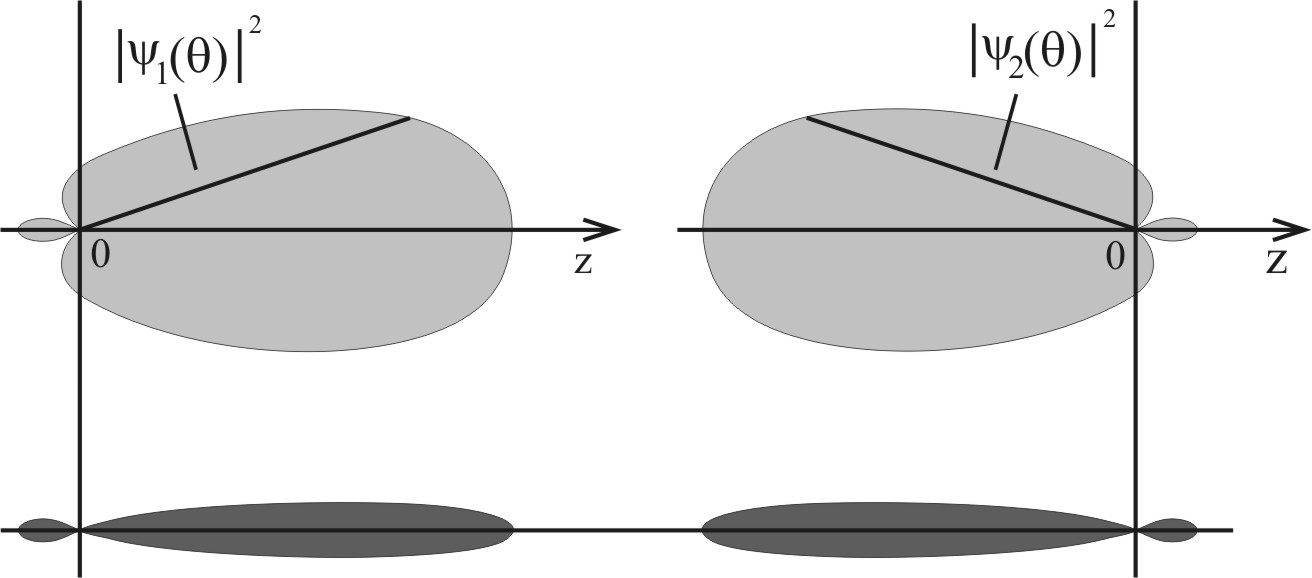
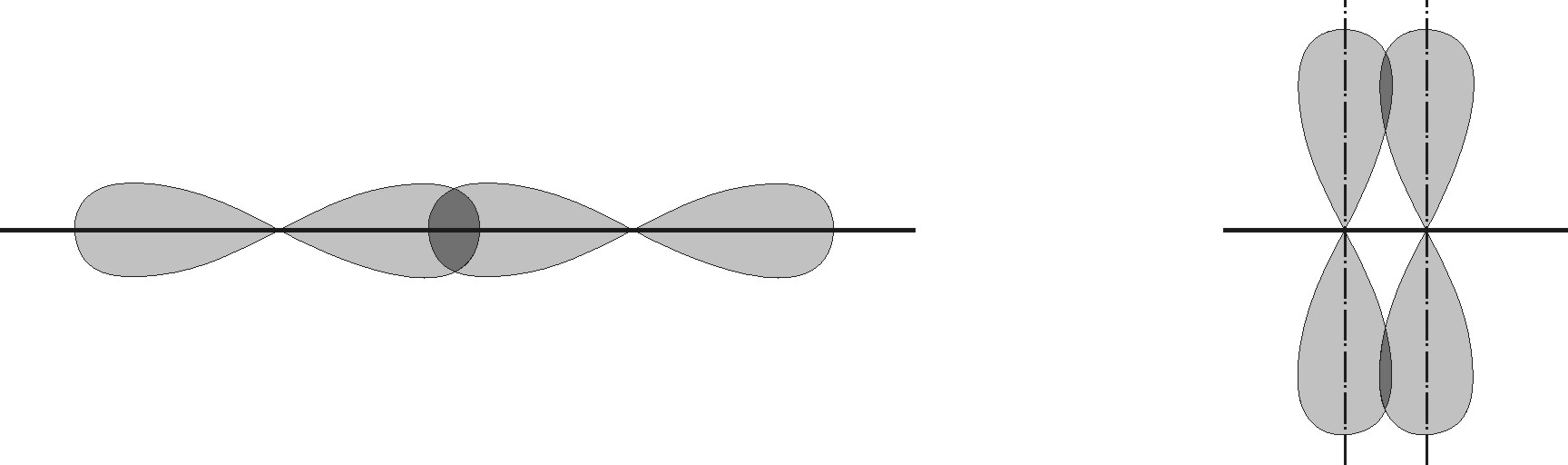
Рис. 4.12. Форма sp -гибридных орбиталей: а) функция 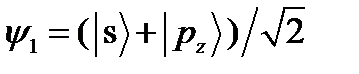 ; б) функция
; б) функция 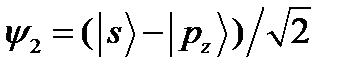 при
при 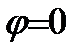 . Под графиками изображено их условные обозначения в молекулярных структурах
. Под графиками изображено их условные обозначения в молекулярных структурах
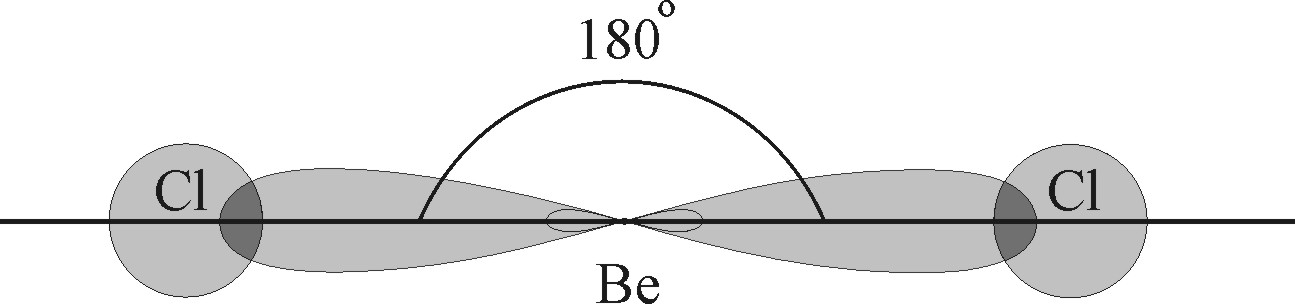
Рис. 4.13. Образование линейной молекулы 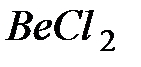 за счет гибридизации
за счет гибридизации  и
и 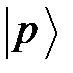 состояний атома
состояний атома 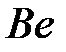
Электронная конфигурация атома бора 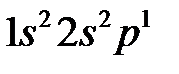 при образовании химического соединения переходит в конфигурацию
при образовании химического соединения переходит в конфигурацию 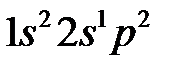 и его валентное состояние характеризуется sр 2-гибридными орбиталями, которые строятся в соответствии с теорией возмущения в случае трехкратного кратного вырождения:
и его валентное состояние характеризуется sр 2-гибридными орбиталями, которые строятся в соответствии с теорией возмущения в случае трехкратного кратного вырождения:
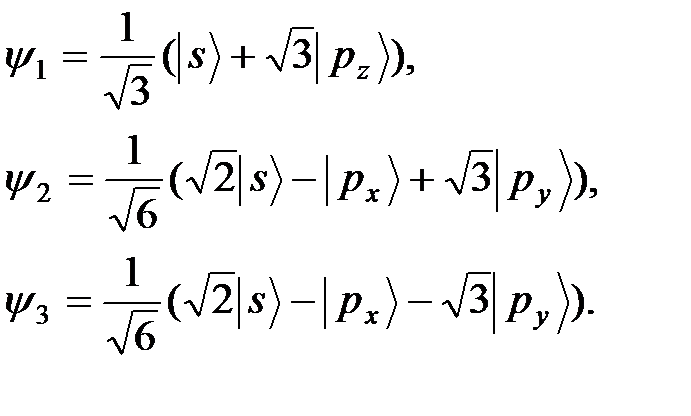 (19)
(19)
sp 2 -гибридизация объясняет, например, плоскую структуру молекул
 (Рис. 4.14.)
(Рис. 4.14.)
|
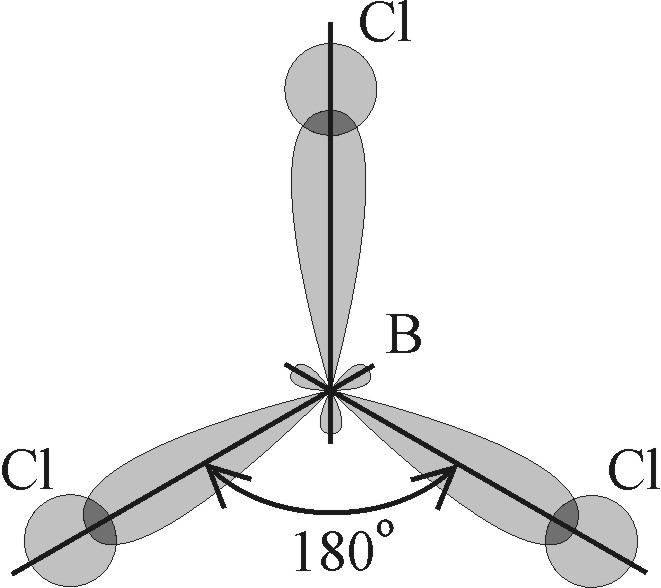
Рис. 4.14. Образование плоской молекулы  за счет гибридизации s -, рx - и py - состояний атома бора за счет гибридизации s -, рx - и py - состояний атома бора
|
Наконец, одно из валентных состояний атома углерода 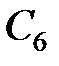 характеризуется четырьмя sp 3 -гибридными орбиталями, направленными к вершинам тетраэдра и называемых поэтому тетраэдральными (Рис. 4.15.):
характеризуется четырьмя sp 3 -гибридными орбиталями, направленными к вершинам тетраэдра и называемых поэтому тетраэдральными (Рис. 4.15.):
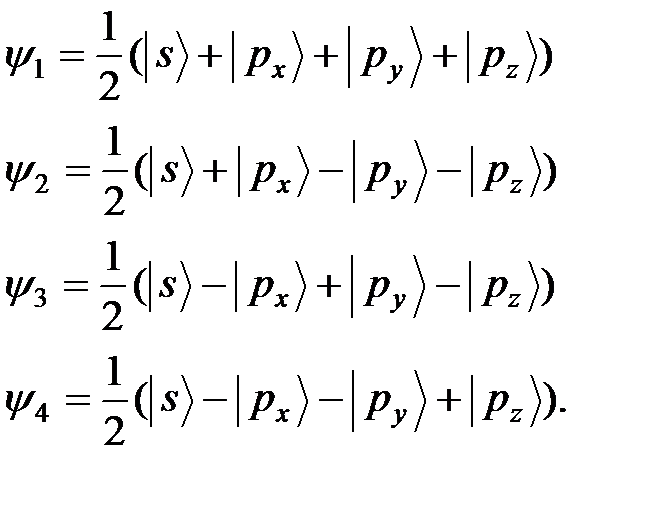 (20)
(20)
В таком валентном состоянии углерод проявляет валентность равную 4.
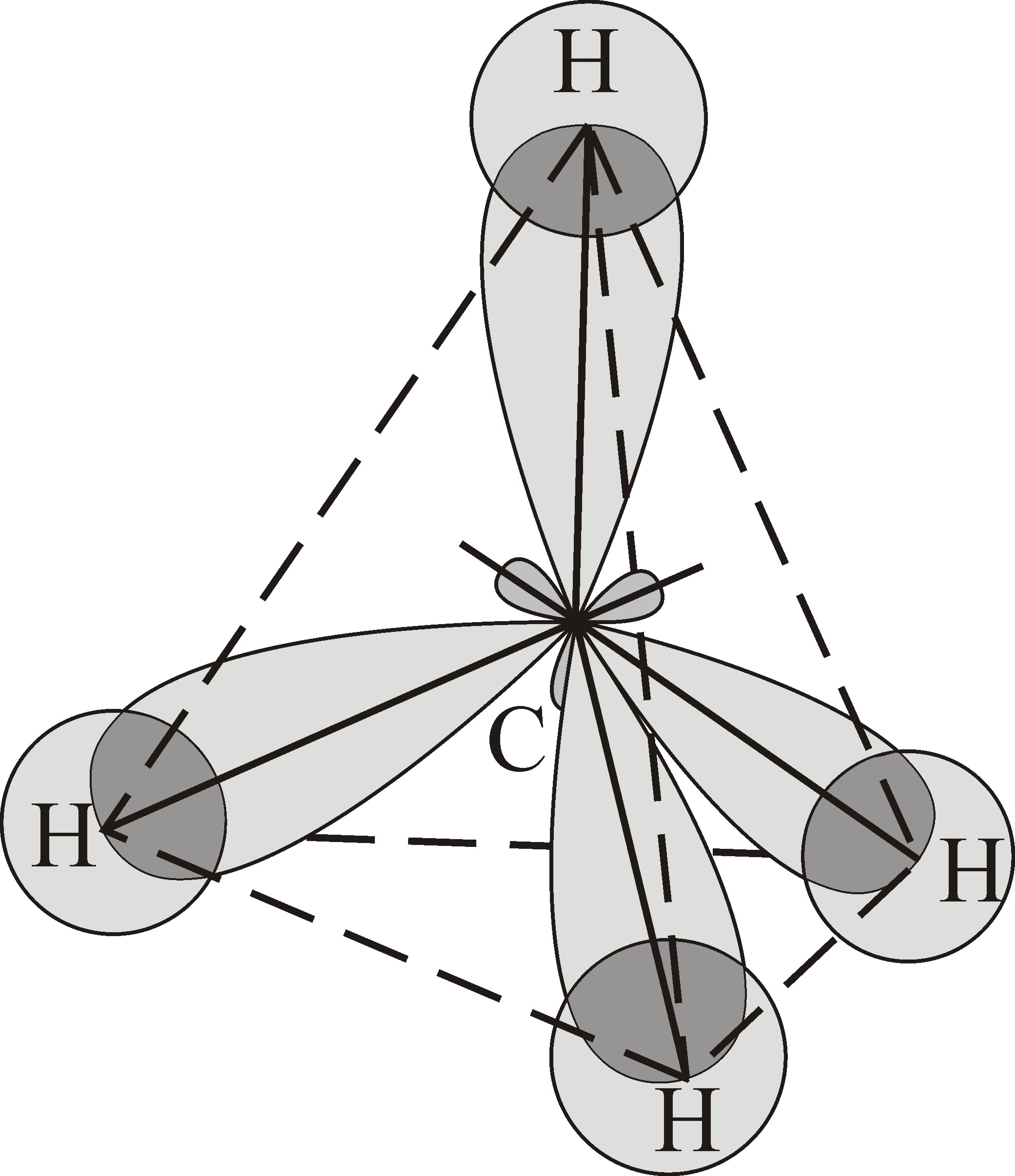
|
Рис. 4.15.Образование тетраэдрической молекулы метана 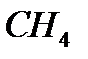 за счет sp 3-гибридизации электронов атома углерода за счет sp 3-гибридизации электронов атома углерода
|
Возможны также и другие валентные состояния углерода, в которых происходит частичная гибридизация, например только между состояниями  и
и 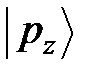 , т.е.
, т.е.  ;
; 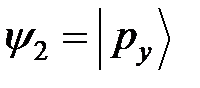 ;
; 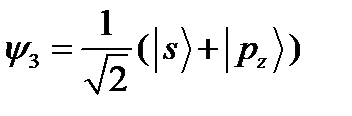 ;
; 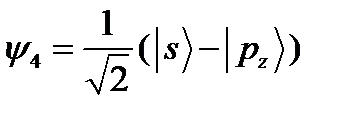 .
.
Такой случай наблюдается в молекуле ацетилена, имеющей линейную структуру Н-С=С-Н. Тройная связь состоит из одной s-связи между гибридными состояниями 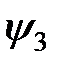 и
и 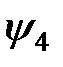 и двумя p-связями. Возможно также валентное состояние углерода, в котором гибридизируются 3 из 4-х валентных электронов с образованием трех s-связей, направленных под углом 120° и одной p-связью. Следует отметить, что энергия, необходимая для перевода атома из основного в валентное состояние, гораздо меньше энергии, выделяемой при образовании химического соединения.
и двумя p-связями. Возможно также валентное состояние углерода, в котором гибридизируются 3 из 4-х валентных электронов с образованием трех s-связей, направленных под углом 120° и одной p-связью. Следует отметить, что энергия, необходимая для перевода атома из основного в валентное состояние, гораздо меньше энергии, выделяемой при образовании химического соединения.
Наличие различных анизотропных атомных орбиталей p, d, f и т.д., их линейных комбинации (совместно с s-состояниями), определяет множественность геометрических структур молекул, а также в значительной степени определяет полиморфизм кристаллов (множественность кристаллических структур) с ионно-ковалентной связью.
Основные свойства ковалентной связи
1) Ковалентная связь образуется за счет обобществления валентных электронов атомов. Каждая ковалентная связь образуется при спаривании электронов. После спаривания электроны не могут образовывать новые химические ковалентные связи: свойство насыщенности ковалентной связи.
2) Ковалентная связь обусловлена, главным образом, обменным взаимодействием валентных электронов атомов. Энергия ковалентной связи определяется значением обменного интеграла, который тем больше, чем больше область перекрывания атомных орбиталей - принцип наибольшего перекрывания.
3) Для образования ковалентной связи необходимо, чтобы: а) энергии валентных электронов атомов были сопоставимы по величине; б) атомные орбитали полнее перекрывались.
4) Электрические свойства молекул с разными ядрами определяются асимметрией электронного облака по отношению к перестановке ядер, которая приводит к поляризации молекулы. Дипольный момент молекулы пропорционален разности электроотрицательностей атомов  , а также разности атомных уровней
, а также разности атомных уровней  , причем первый фактор, как правило, является преобладающим.
, причем первый фактор, как правило, является преобладающим.
5) Ковалентная связь направленная. При образовании молекул атомные орбитали перестраиваются в гибридные орбитали (линейные комбинации s, p, d, f... состояний), в результате чего формируются различные пространственные структуры молекул и твердых тел.
Date: 2015-05-19; view: 2938; Нарушение авторских прав