
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Слои и оболочки
|
|
Состояние электрона в кулоновском поле ядра (т.е. водородоподобном атоме) характеризуется четырьмя квантовыми числами:
1) главным квантовым числом n =1, 2, 3,…, которое определяет спектр энергии водородоподобного атома
 , (1)
, (1)
2) орбитальным квантовым числом l = 0, 1, 2, 3,… n –1, характеризующим соответственно s, p, d, f,… состояния; с орбитальным числом l связан модуль вектора орбитального углового момента электрона
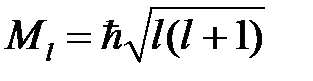 , (2)
, (2)
3) магнитным квантовым числом 
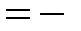 l, - l + 1,…0,… l – 1, l (всего 2 l +1 значений), определяющим проекцию на ось
l, - l + 1,…0,… l – 1, l (всего 2 l +1 значений), определяющим проекцию на ось  орбитального углового момента
орбитального углового момента
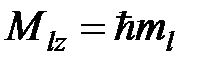 , (3)
, (3)
4) магнитное спиновое число m s=±½, определяющее две возможные проекции спинового углового момента
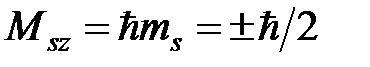 . (4)
. (4)
В первом приближении состояние электрона в многоэлектронном атоме характеризуется теми же квантовыми числами, что и в водородоподобном атоме.
В основе строения электронных оболочек атома лежат два принципа:
1) принцип Паули: в атоме может существовать только один электрон, характеризуемый значениями четырех квантовых чисел, т.е. два электрона в атоме должны различаться значениями, по крайней мере, одного квантового числа;
2) принцип минимума энергии: при данном общем числе электронов в атоме осуществляется состояние с минимальной энергией.
В структуре атома выделяют слои и оболочки. Совокупность электронов, обладающих одинаковым главным квантовым числом n, образуют электронный слой. Для различных значений n слои имеют обозначения, принятые в спектроскопии рентгеновских лучей:
n …1, 2, 3, 4, 5…
слой…K, L, M, N, O…
Совокупность электронов, имеющих одинаковые n и l, образуют электронную оболочку. Оболочки, принадлежащие данному слою, обозначаются соответственно:
l …0, 1, 2, 3… n –1
оболочки… s, p, d, f …
Количество электронных состояний в электронной оболочке очевидно равно 2(2 l +1), а в слое – сумме вида:
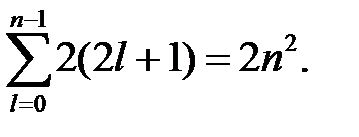
В водородоподобном атоме все электронные состояния, принадлежащие данному электронному слою, имеют одинаковую энергию, определяемую формулой (1). Ситуация, когда одному собственному значению соответствует N собственных функций, называют N -кратным вырождением. Таким образом, кратность вырождения каждого уровня энергии En водородоподобного атома равна 2 n 2. В многоэлектронном атоме это вырождение снимается возмущениями различной природы: взаимодействием с другими электронами, спин-орбитальным взаимодействием, взаимодействием с магнитным моментом ядра и нулевыми колебаниями вакуума. Поэтому, строго говоря, все электроны в многоэлектронном атоме имеют разную энергию.
Date: 2015-05-19; view: 1097; Нарушение авторских прав