
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение Ван-дер-Ваальса и межмолекулярное взаимодействие
|
|
Как известно, поведение реальных газов хорошо передается уравнением состояния Ван-дер-Ваальса
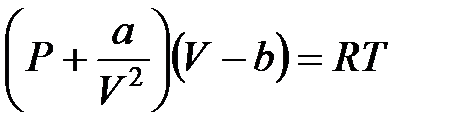 , (1)
, (1)
где 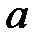 - поправка на давление, выражаюшая наличие взаимного притяжения молекул,
- поправка на давление, выражаюшая наличие взаимного притяжения молекул, 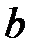 - наименьший объем, который может занимать грамм-молекула вещества, связанный с наличием сил отталкивания между молекулами.
- наименьший объем, который может занимать грамм-молекула вещества, связанный с наличием сил отталкивания между молекулами.
Силы отталкивания, возникающие между атомами (молекулами) вызваны, в основном, отталкиванием заполненных электронных оболочек атомов из-за их обменного взаимодействия в соответствии с принципом Паули, а также кулоновским отталкиванием ядер. Потенциал отталкивания трудно поддается точному расчету. Обычно его аппроксимируют экспоненциальной, 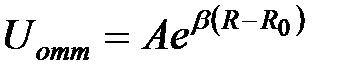 , или степеней функцией
, или степеней функцией 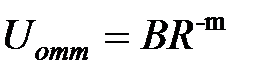 , где
, где 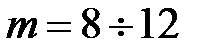 , a параметры
, a параметры 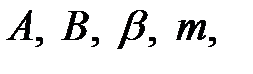 определяются эмпирическим путем. Поскольку в реальных газах не происходит образование химических связей, то силы притяжения, выражаемые поправкой
определяются эмпирическим путем. Поскольку в реальных газах не происходит образование химических связей, то силы притяжения, выражаемые поправкой 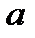 в уравнении (1), не сводятся к рассмотренным выше типам связи и имеют совершенно другую природу. В то же время, учитывая общность уравнения состояния реальных газов, можно утверждать, что эти силы носят универсальный характер и действуют между любыми атомами или молекулами. Их называют силами Ван-дер-Ваальса. Если химическая, связь обусловлена, в основном, переносом заряда, то силы Ван-дер-Ваальса действуют на расстояниях, при которых этот перенос еще не возможен и поэтому обусловленный мультиполь-мультиполным взаимодействием нейтральных атомов или молекул. По характеру этого взаимодействия различают ориентационные, индукционные и дисперсионные силы или силы Лондона.
в уравнении (1), не сводятся к рассмотренным выше типам связи и имеют совершенно другую природу. В то же время, учитывая общность уравнения состояния реальных газов, можно утверждать, что эти силы носят универсальный характер и действуют между любыми атомами или молекулами. Их называют силами Ван-дер-Ваальса. Если химическая, связь обусловлена, в основном, переносом заряда, то силы Ван-дер-Ваальса действуют на расстояниях, при которых этот перенос еще не возможен и поэтому обусловленный мультиполь-мультиполным взаимодействием нейтральных атомов или молекул. По характеру этого взаимодействия различают ориентационные, индукционные и дисперсионные силы или силы Лондона.
4.3.2. Ориентационное взаимодействие
Ориентационное взаимодействие возникает между молекулами, имеющими постоянный дипольный момент в свободном состоянии 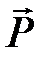 . Из электростатики известно, что потенциальная энергия взаимодействия двух диполей
. Из электростатики известно, что потенциальная энергия взаимодействия двух диполей 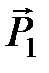 и
и 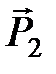 , находящихся на расстоянии R друг от друга дается выражением
, находящихся на расстоянии R друг от друга дается выражением
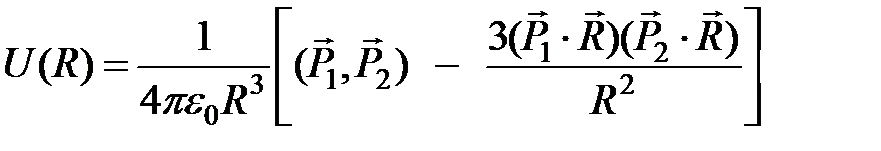 . (2)
. (2)
Диполи притягиваются, если они антипараллельны и расположены на одной линии. В этом случае из (2) получим
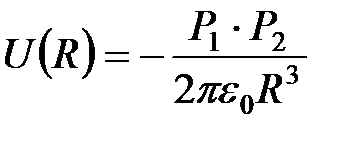 , (3)
, (3)
Тепловое движение молекул препятствует их ориентации и, следовательно, ориентационному взаимодействию. Ученик Ван-дер-Ваальса Кеезом в 1912 г. развил теорию ориентационного взаимодействия, основанную на усреднении потенциала парного взаимодействия (2) системы разоориентированных молекул при температуре 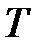 и получил выражение:
и получил выражение:
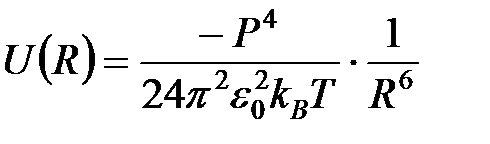 . (4)
. (4)
Date: 2015-05-19; view: 852; Нарушение авторских прав