
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Эффект экранирования
|
|
Наиболее сильное возмущение, вызывающее расщепление уровней электронов, принадлежащих электронному слою, связано с эффектом экранирования кулоновского поля ядра другими электронами слоя. Сравним, для примера, 2 s - и 2 p -состояния водородоподобного атома. В состоянии 2 s n =2, l =0, k =1 (где k = n–l –1 – радиальное квантовое число, равное числу узлов волновой функции). В состоянии 2 p n =2, l =1, k =0.
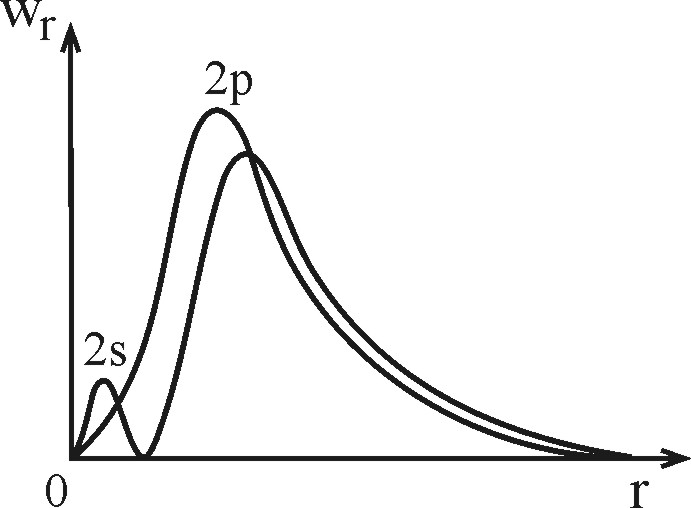
| Рис. 3.4. Радиальная плотность вероятности для 2 s и 2 p состояния атома водорода |
Радиальные плотности вероятности 2 p - и 2 s -состояний показаны на рис. 3.4 как функции r. Из рисунка видно, что 2 s -электрон с некоторой вероятностью находится в области между ядром и 2 p -электроном.
В водородоподобном атоме единственный электрон движется в кулоновском поле ядра и состояния 2 s и 2 p имеют одинаковую энергию. Если в атоме имеется и 2 s - и 2 p -электрон, то вследствие частичного экранирования поля ядра 2 s -электроном энергия связи с ядром 2 p -электрона будет меньше, чем энергия связи 2 s -электрона.
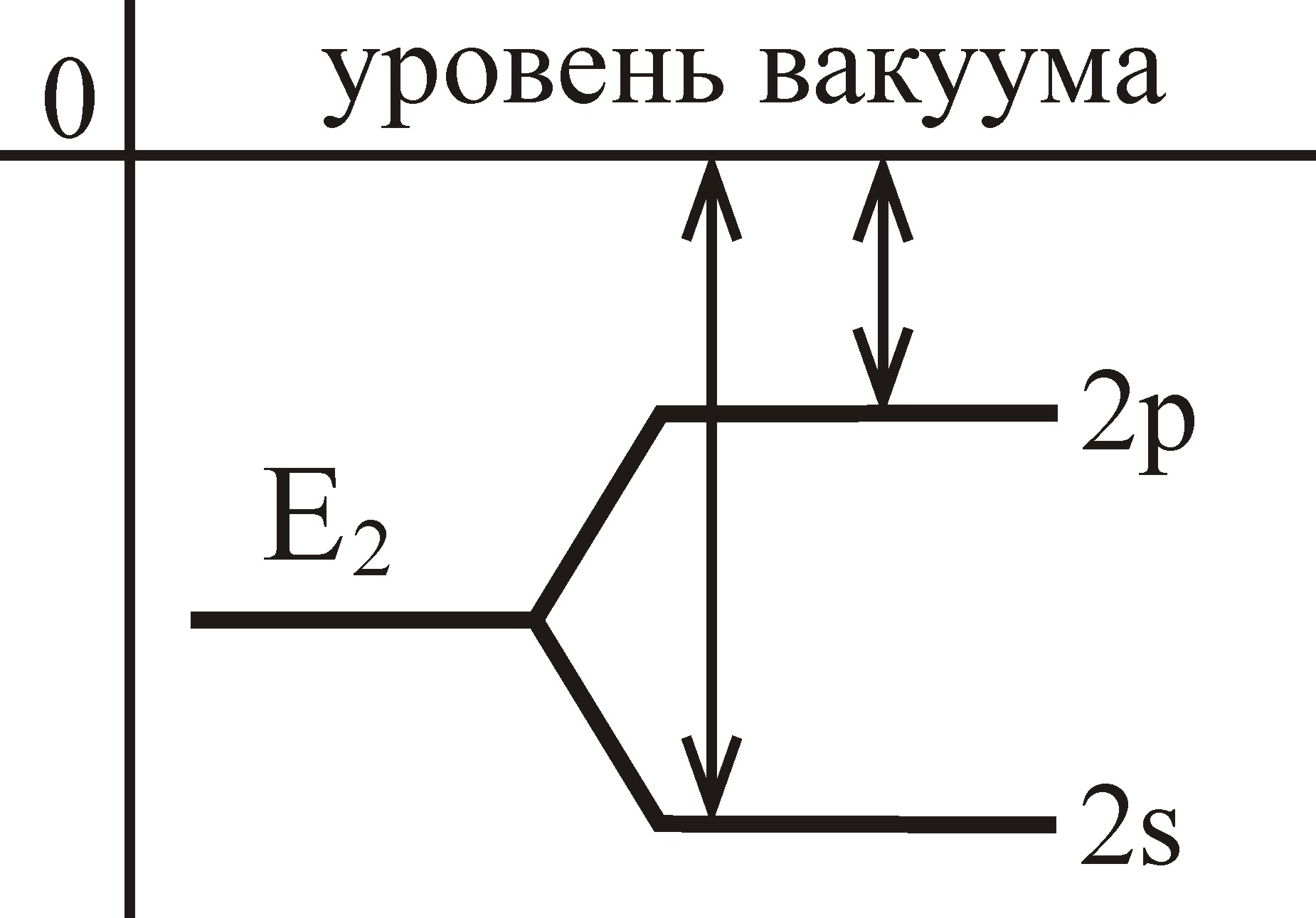
|
Рис. 3.5. Расщепление заполненных электронных состояний 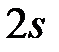 и и 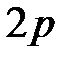 вследствие эффекта экранирования вследствие эффекта экранирования
|
Вследствие эффекта экранирования электронные оболочки, принадлежащие данному электронному слою имеют разную энергию. Заполнение электронных слоев происходит в соответствии с правилами Клечковского:
1. Заполнение электронами электронных состояний происходит с ростом суммы квантовых чисел n + l.
2. При совпадении значений суммы (n + l) меньшую энергию имеет состояние с меньшим значением главного квантового числа n.
Отклонение от «идеальной» схемы заполнения, как видно из рис. 3.6, происходит с ростом порядкового номера Z после калия К. С калия начинается присоединение следующего электрона не в состояние 3 d, а в более энергетически выгодное состояние 4 s и соответственно начинается заполнение четвертого электронного слоя, т.е. четвертый период периодической системы. Конфигурация следующего после калия элемента кальция Са есть (Ar)4 s 2. После этого энергетически более выгодным оказывается заполнение 3 d -состояний, которые остались незаполненными. У последующих элементов от скандия Sc до никеля Ni происходит заполнение 3 d -состояний. Эти элементы называют 3d-переходными металлами. У следующего за никелем элемента меди Cu добавляется один электрон, при этом энергетически более выгодным является перераспределение электронов, в результате которого 3 d -состояние оказывается полностью заполненным, а в 4 s -состоянии остается лишь один электрон и электронная конфигурация меди аналогична конфигурации щелочных металлов. У последующих элементов происходит заполнение 4 s - и 4 p -оболочки, т.е. конфигурации внешних электронов повторяют конфигурацию второго и третьего периодов, что снова соответствует «идеальной» схеме заполнения. У криптона Kr завершается заполнение 4 s - и 4 p -состояний, поэтому криптон является инертным газом. На криптоне завершается первый большой период периодической системы, состоящий из 18-ти элементов. В четвертом периоде, начиная с рубидия Rb, заполнение электронных состояний также происходит с отклонением от «идеальной» схемы, так как заполнение 5 s -состояния оказывается энергетически более выгодным, чем заполнение 4 d - и 4 f -состояний. У ксенона Xe завершается заполнение 4 d -состояния, 5 s - и 5 p -состояний, но 4 f -состояние, 5 d -, 5 f -, 5 g -состояния остаются незаполненными. У цезия Cs и бария Ba заполняются 6 s -состояния. Затем у лантана дополнительный электрон добавляется на внутреннюю оболочку в 5 d -состоянии, а у следующих за ним 14 элементов заполняются 4 f -состояния. Поскольку электроны в 4 f -состоянии являются внутренними (более внешние оболочки уже заполнены), это заполнение 4 f -состояний существенно не

Энергия водородоподобного
атома
Рис. 3.6. Схема заполнения электронных состояний многоэлектронного атома
изменяет химических свойств элементов, которые определяются внешними электронами оболочки атома. Поэтому все эти 14 элементов имеют близкие химические свойства и занимают в периодической системе одну клетку под именем лантаноидов. Аналогичная ситуация повторяется после актиния Ас, когда заполняются, в основном, 5 f -состояния. Соответствующие элементы составляют группу актинидов. Из актинидов только торий Tr, протактиний Ра и уран U существуют устойчиво в природе, остальные были получены лишь искусственно в лабораторных условиях. Эти элементы называют трансурановыми. Их нестабильность обусловлена неустойчивостью ядер относительно спонтанного деления. Таким образом, квантовая механика в целом хорошо объясняет все основные закономерности периодической системы Д.И.Менделеева.
Date: 2015-05-19; view: 2628; Нарушение авторских прав