
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Правила Хунда. Термы атомов
|
|
Последовательность заполнения электронных оболочек атомов определяется правилами Хунда. В зависимости от контекста обычно используют две формулировки этого правила.
Формулировка I: сначала заполняются состояния с различными значениями магнитного квантового числа 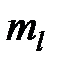 (
(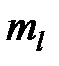 = - l, - l +1, … l -1, l) при одинаковом значении проекции спина (например, при
= - l, - l +1, … l -1, l) при одинаковом значении проекции спина (например, при 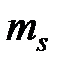 =1/2); после того, как все 2 l +1 состояний по квантовому числу
=1/2); после того, как все 2 l +1 состояний по квантовому числу 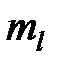 будут заполнены электронами с одинаковой проекцией спина, начинается их заполнение электронами с противоположной проекцией спина (при
будут заполнены электронами с одинаковой проекцией спина, начинается их заполнение электронами с противоположной проекцией спина (при 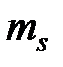 = -1/2).
= -1/2).
Например, в p -состоянии (l =1) может быть помещено всего 2(2 l +1)=6 электронов. Последовательность заполнения состояний может быть представлена следующим образом:
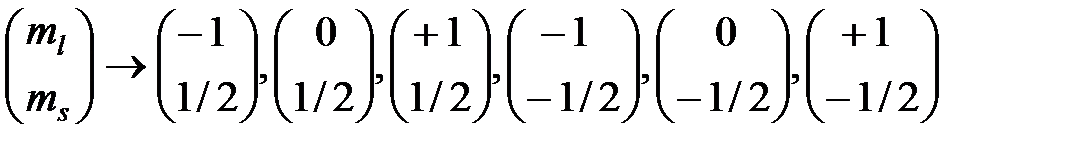 .
.
В спектроскопии состояние атома принято символически обозначать в виде терма 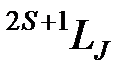 , где S, L, и J - спин, орбитальное число и полный момент атома соответственно. Состояния атома с различными значениями L =0,1,2,3,… обозначаются соответственно заглавными латинскими буквами S, P, D, F …
, где S, L, и J - спин, орбитальное число и полный момент атома соответственно. Состояния атома с различными значениями L =0,1,2,3,… обозначаются соответственно заглавными латинскими буквами S, P, D, F …
Для вычисления квантовых чисел атома S, L, и J используют другую формулировку правил Хунда:
Формулировка II:
1. У полностью заполненной электронной оболочки квантовые числа S, L, и J равны нулю.
2. Незаполненная электронная оболочка имеет максимально возможный спин S.
3. Орбитальное число L должно быть максимально возможным при выбранном значении спина S.
4. Если оболочка заполнена меньше, чем наполовину, то J= 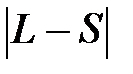 , если больше, то J=L+S.
, если больше, то J=L+S.
Рассмотрим, для примера, терм атома углерода 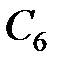 . Электронная конфигурация углерода:
. Электронная конфигурация углерода: 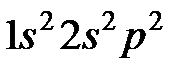 . 1 s и 2 s -оболочки полностью заполнены, поэтому у этих оболочек все моменты (спиновой, орбитальный, и полный) равны нулю. В p -оболочке имеются два электрона. Суммарный спин p -оболочки должен быть максимально возможным, т.е. S =1, что соответствует параллельным спинам (
. 1 s и 2 s -оболочки полностью заполнены, поэтому у этих оболочек все моменты (спиновой, орбитальный, и полный) равны нулю. В p -оболочке имеются два электрона. Суммарный спин p -оболочки должен быть максимально возможным, т.е. S =1, что соответствует параллельным спинам (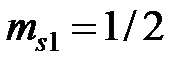 ,
, 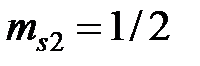 ). Орбитальные числа отдельных электронов этой оболочки равны единице:
). Орбитальные числа отдельных электронов этой оболочки равны единице: 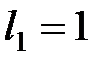 ,
, 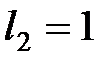 . Суммарный орбитальный момент оболочки в соответствии с правилом сложения моментов определяется квантовым числом L, которое пробегает значения от
. Суммарный орбитальный момент оболочки в соответствии с правилом сложения моментов определяется квантовым числом L, которое пробегает значения от 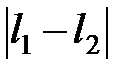 до
до 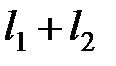 через единицу, т.е. L =0, 1, 2. Состояние с L =2, соответствующее параллельным орбитальным моментам, не согласуется с принципом Паули, т.к. в этом случае два p -электрона будут находиться в одинаковых квантовых состояниях. Поэтому максимально возможное орбитальное число L =1. Так как оболочка заполнена меньше чем на половину (в p -оболочке можно разместить до шести электронов), то
через единицу, т.е. L =0, 1, 2. Состояние с L =2, соответствующее параллельным орбитальным моментам, не согласуется с принципом Паули, т.к. в этом случае два p -электрона будут находиться в одинаковых квантовых состояниях. Поэтому максимально возможное орбитальное число L =1. Так как оболочка заполнена меньше чем на половину (в p -оболочке можно разместить до шести электронов), то 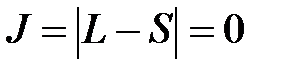 . Таким образом, в соответствии с правилами Хунда для основного состояния атома углерода S =1, L =1 (P -состояние атома) и J =0. Терм атома углерода соответственно имеет вид:
. Таким образом, в соответствии с правилами Хунда для основного состояния атома углерода S =1, L =1 (P -состояние атома) и J =0. Терм атома углерода соответственно имеет вид: 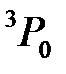 .
.
Date: 2015-05-19; view: 3997; Нарушение авторских прав