
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Спектр энергии и волновые функции электрона в атоме водорода
|
|
Атом водорода представляет задачу двух тел – квантовый аналог задачи Кеплера в классической механике. Потенциальная энергия взаимодействия электрона с протоном определяется законом Кулона:
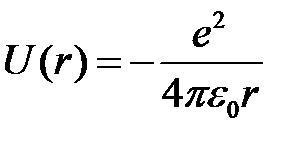 . (1)
. (1)
Из-за большой разницы масс электрона и протона последний можно считать неподвижным, а электрон - движущимся в независящем от времени потенциальном поле U (r) (1), которое зависит только от расстояния 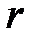 электрона до центра (протона). Таким образом, атом водорода представляет пример движения частицы в центрально-симметричном потенциальном поле. Как известно, в таком поле помимо энергии En сохраняется квадрат углового момента M 2= ħ 2 l (l +1) и проекция углового момента на ось
электрона до центра (протона). Таким образом, атом водорода представляет пример движения частицы в центрально-симметричном потенциальном поле. Как известно, в таком поле помимо энергии En сохраняется квадрат углового момента M 2= ħ 2 l (l +1) и проекция углового момента на ось 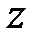 : Mz = ħm, где l и m – орбитальное и магнитное квантовые числа соответственно. Поэтому волновая функция электрона в атоме водорода является одновременно собственной функцией операторов
: Mz = ħm, где l и m – орбитальное и магнитное квантовые числа соответственно. Поэтому волновая функция электрона в атоме водорода является одновременно собственной функцией операторов 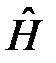 ,
, 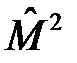 и
и 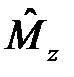 . В сферической системе координат волновую функцию электрона можно представить в виде:
. В сферической системе координат волновую функцию электрона можно представить в виде:
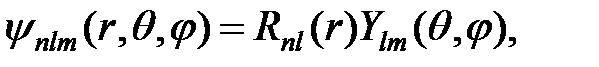 (2)
(2)
где 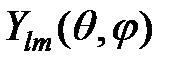 – сферические функции – собственные функции оператора
– сферические функции – собственные функции оператора 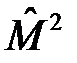 :
:
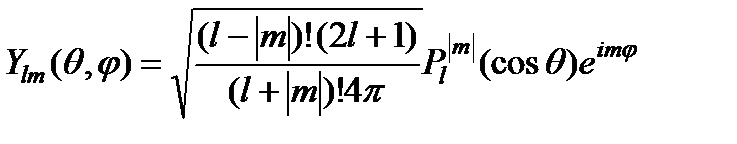 . (3)
. (3)
Радиальная волновая функция Rnl (r) определяется видом потенциальной функции U (r). Физический смысл угловой и радиальной составляющих волновой функции можно выяснить, подставляя (2) в условие нормировки:
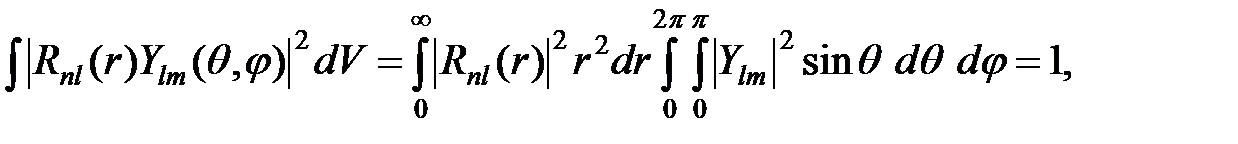 (4)
(4)
где 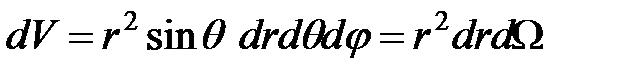 – элемент объёма в сферической системе координат, а
– элемент объёма в сферической системе координат, а 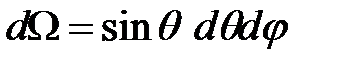 – элемент телесного угла.
– элемент телесного угла.
Так как сферические функции нормированы, то
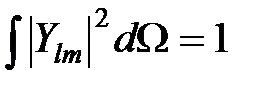 . (5)
. (5)
Отсюда получаем условие нормировки для радиальной волновой функции:
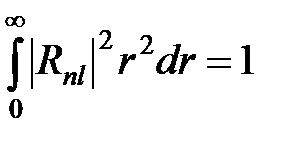 . (6)
. (6)
Равенство (5) выражает условие нормировки для сферических функций и (6) – для радиальной волновой функции, откуда ясно, что 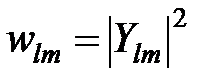 есть угловая плотность вероятности, т.е. вероятность обнаружить электрон в единице телесного угла, а
есть угловая плотность вероятности, т.е. вероятность обнаружить электрон в единице телесного угла, а 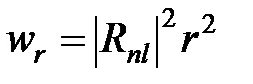 есть радиальная плотность вероятности, т.е. вероятность обнаружить электрон в сферическом кольце единичной толщины, а
есть радиальная плотность вероятности, т.е. вероятность обнаружить электрон в сферическом кольце единичной толщины, а 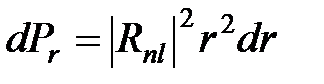 – вероятность найти электрон в бесконечно тонком, толщиной dr сферическом кольце радиусом r.
– вероятность найти электрон в бесконечно тонком, толщиной dr сферическом кольце радиусом r.
Запишем теперь уравнение Шрёдингера в сферической системе координат:
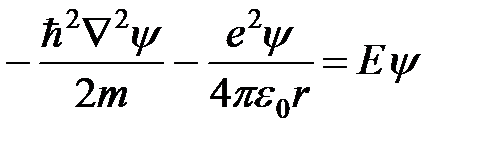 .
.
Учитывая, что 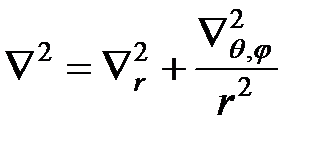 ,
,
где 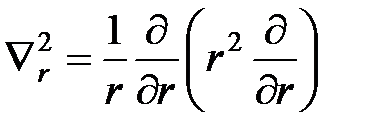 ;
; 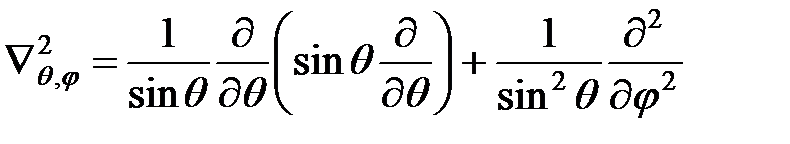 , получим
, получим
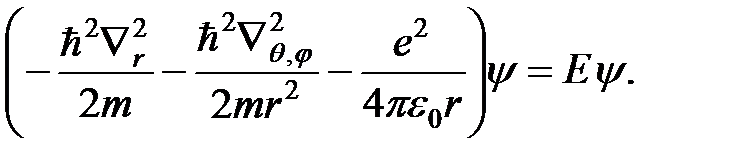
Так как оператор 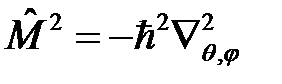 , а
, а 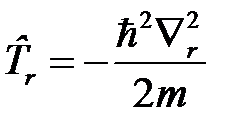 – оператор кинетической энергии движения электрона по радиусу-вектору, то
– оператор кинетической энергии движения электрона по радиусу-вектору, то
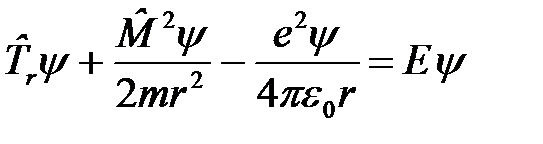 . (7)
. (7)
Сферические функции Ylm являются собственными функциями оператора 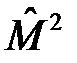 , поэтому
, поэтому
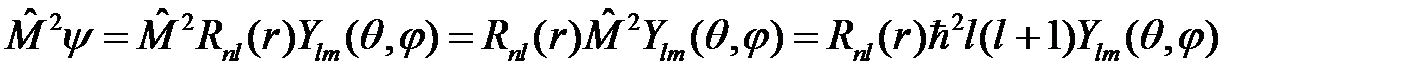 . Подставляя
. Подставляя  в уравнение (7), после сокращения на Ylm получим радиальное уравнение Шрёдингера:
в уравнение (7), после сокращения на Ylm получим радиальное уравнение Шрёдингера:
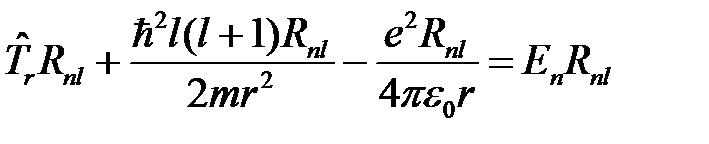 . (8)
. (8)
1. Спектр энергии атома водорода
Собственные значения энергии электрона:
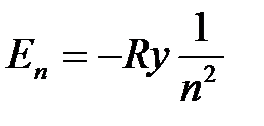 ,
,
где 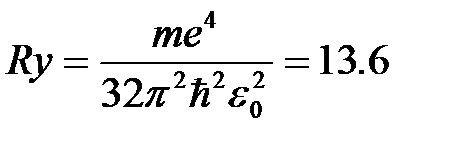 эВ – постоянная, называемая Ридбергом.
эВ – постоянная, называемая Ридбергом.
|
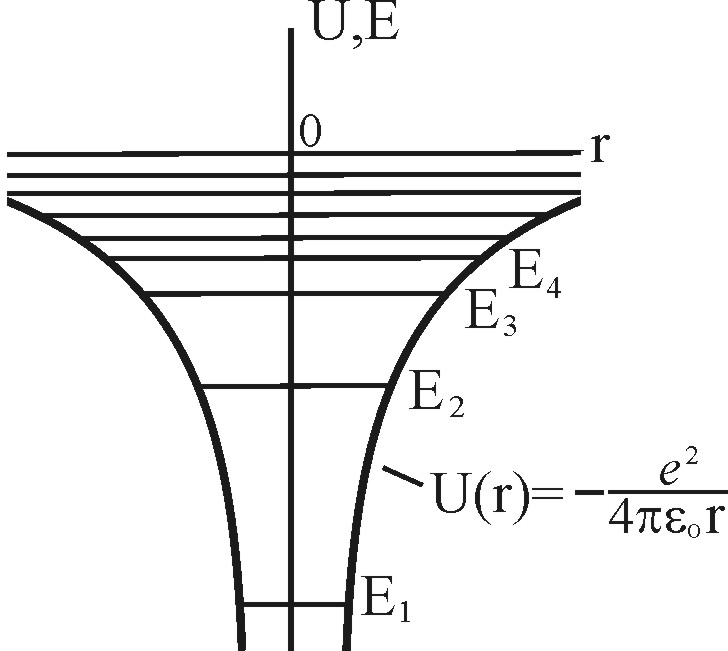
Рис. 3.1. Гиперболическая потенциальная яма 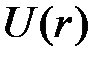 и спектр энергии атома водорода и спектр энергии атома водорода
|
Ридберг численно равен энергии ионизации атома водорода I = Ry. Переходы электрона с любого возбужденного уровня на уровень E 1, дают спектральную серию Лаймана, с любого на Е 2 – серию Бальмера, далее на третий Е 3 – серию Пашена и т. д.
Таким образом, спектр излучения (поглощения) атома водорода – дискретный, т. е. состоит из отдельных спектральных линий, отвечающих переходам между дискретными энергетическими уровнями электрона.
2. Радиальные волновые функции
Решениями радиального уравнения Шрёдингера (8) являются радиальные волновые функции, выраженные через безразмерную координату 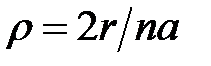 , где a = ħ 2/ me 2 – первый боровский радиус.
, где a = ħ 2/ me 2 – первый боровский радиус.
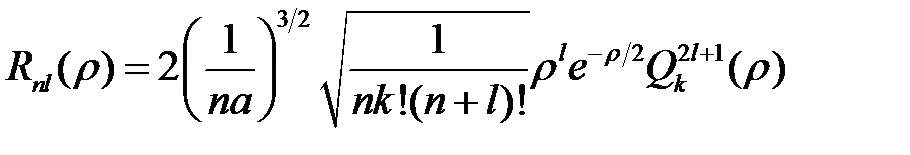 , (9)
, (9)
где 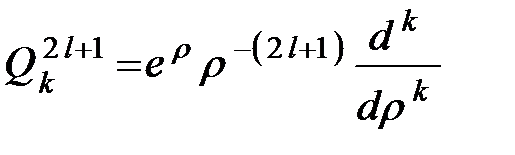 (
(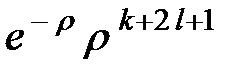 ) – полином Лагерра, k – радиальное квантовое число, равно числу узлов радиальной волновой функции Rnl (r), n = l + k +1 – главное квантовое число, l – орбитальное квантовое число. Волновые функции с l = 0,1,2,3…
) – полином Лагерра, k – радиальное квантовое число, равно числу узлов радиальной волновой функции Rnl (r), n = l + k +1 – главное квантовое число, l – орбитальное квантовое число. Волновые функции с l = 0,1,2,3…  обозначается соответственно как s, p, d, f … состояния.
обозначается соответственно как s, p, d, f … состояния.
Date: 2015-05-19; view: 1866; Нарушение авторских прав