
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства жидкости
|
|
Между молекулами вещества действуют силы молекулярного притяжения и отталкивания. На рис.12 изображена зависимость сил отталкивания и притяжения двух соседних молекул от расстояния между их центрами. Равнодействующая сил притяжения и отталкивания, действующих на каждую молекулу, изображена пунктирной линией. Эта равнодействующая дважды обращается в нуль – при расстояниях 2 rM и r 0. Условно rM называют радиусом молекулы, а r 0 – радиусом сферы молекулярного действия ( см;
см;  см). Когда расстояние между центрами молекул становится меньше 2 rM, превалируют силы отталкивания. Проведем вокруг какой-либо молекулы сферу радиусом r 0. Центральная молекула притягивается ко всем молекулам, находящимся внутри этой сферы (рис. 13). Если в пределах сферы молекулярного действия плотность вещества одинакова, то равнодействующая сил притяжения, действующих на центральную молекулу, равна нулю. Если же плотность вещества неодинакова, то равнодействующая сил молекулярного притяжения не равна нулю и направлена в сторону большей плотности. Поэтому на каждую молекулу поверхностного слоя толщиной r 0 действуют силы молекулярного притяжения, перпендикулярные поверхности и направленные в глубь жидкости (рис.14). Под действием этих сил молекулы стремятся уйти с поверхности в глубину.
см). Когда расстояние между центрами молекул становится меньше 2 rM, превалируют силы отталкивания. Проведем вокруг какой-либо молекулы сферу радиусом r 0. Центральная молекула притягивается ко всем молекулам, находящимся внутри этой сферы (рис. 13). Если в пределах сферы молекулярного действия плотность вещества одинакова, то равнодействующая сил притяжения, действующих на центральную молекулу, равна нулю. Если же плотность вещества неодинакова, то равнодействующая сил молекулярного притяжения не равна нулю и направлена в сторону большей плотности. Поэтому на каждую молекулу поверхностного слоя толщиной r 0 действуют силы молекулярного притяжения, перпендикулярные поверхности и направленные в глубь жидкости (рис.14). Под действием этих сил молекулы стремятся уйти с поверхности в глубину.
Вместе с тем молекулы поверхностного слоя обладают избытком потенциальной энергии по сравнению с молекулами, находящимися в глубине жидкости. Устойчивое равновесие жидкости связано с минимумом потенциальной энергии, т.е. с минимально возможной в данном состоянии величиной поверхности жидкости.
При изотермическом увеличении площади поверхности жидкости совершенная работа равна увеличению свободной поверхностной энергии
 ,
,
где w S – свободная энергия одной молекулы на поверхности жидкости; w V – свободная энергия одной молекулы в глубине; D N – число молекул, выведенных из глубины на поверхность жидкости. Величина, численно равная работе изотермического увеличения поверхности жидкости на единицу, называется коэффициентом поверхностного натяжения:
 .
.
Обозначим  – изменение свободной поверхностной энергии одной молекулы, а
– изменение свободной поверхностной энергии одной молекулы, а  –число молекул единицы поверхности жидкости. Тогда
–число молекул единицы поверхности жидкости. Тогда
 .
.
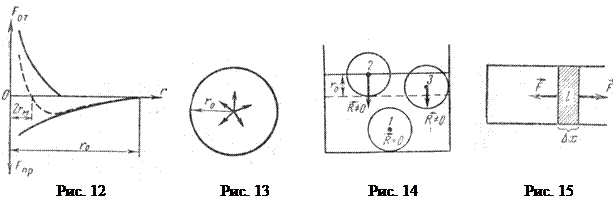 |
Между молекулами поверхностного слоя, как показывает опыт, действуют силы поверхностного натяжения, направленные по касательной к поверхности перпендикулярно любой линии на поверхности жидкости. Можно предположить, что молекулы поверхностного слоя расположены на расстояниях, несколько больших 2 rM (см. рис. 12), эти расстояния уменьшаются по мере удаления от поверхности и становятся несколько меньше 2 rM на глубине
 (см. рис.14).
(см. рис.14).
Силы поверхностного натяжения – это силы взаимного притяжения молекул. Работу увеличения поверхности можно подсчитать, например, при увеличении поверхности мыльной пленки (рис. 15):
 ,
,
где F 1 – внешняя сила, равная силе поверхностного натяжения, действующей на всю границу поверхности 2 l, противоположно направленная:  . Здесь F – сила поверхностного натяжения, действующая на границу l. Но у пленки две поверхности. Получаем:
. Здесь F – сила поверхностного натяжения, действующая на границу l. Но у пленки две поверхности. Получаем:
 .
.
Коэффициент поверхностного натяжения измеряется силой поверхностного натяжения, действующей по касательной к поверхности на единицу длины произвольного контура на поверхности жидкости.
Этот коэффициент зависит от рода жидкости, т. е. от соотношения свободной поверхностной энергии и энергии молекулы в глубине жидкости, а также от плотности жидкости, так как от нее зависит число молекул единицы поверхности. При нагревании жидкости уменьшается как Dw, так и n, потому коэффициент поверхностного натяжения также уменьшается.
Рассматривая молекулы поверхностного слоя, мы пренебрегли действием молекул из верхней части сферы молекулярного действия. Но по мере роста температуры растет плотность пара над поверхностью, а плотность жидкости даже уменьшается. Поэтому равнодействующая сил молекулярного притяжения, действующая на каждую молекулу поверхностного слоя, уменьшается. При критической температуре, когда исчезает различие между жидкостью и ее паром, эта равнодействующая обращается в нуль, исчезает поверхностный слой, обращается в нуль Dw и, следовательно, коэффициент поверхностного натяжения.
ФАЗОВЫЕ ПЕРЕХОДЫ
Гомогенной называется однородная система, во всех точках которой все параметры одинаковы. Гетерогенной системой называется сложная система, состоящая из нескольких гомогенных частей (например, лед – вода – пар). Совокупность гомогенных частей гетерогенной системы, которую можно механическим путем отделить от системы, называется фазой.
Фазовым переходом первого рода называется фазовое превращение, сопровождающееся поглощением или выделением количества теплоты и изменением цельного объема (например, плавление, кипение, конденсация). Фазовый переход первого рода всегда изотермичен, причем температура перехода зависит от давления. Во время фазового перехода сохраняется двухфазное состояние, но плавно меняется соотношение масс каждой фазы. Такой переход можно изобразить, например, на p - T – диаграмме (рис. 16). Плавность кривой p (T) показывает отсутствие скачка параметров, характеризующих состояние вещества.
 Фазовым переходом второго рода называется переход, не связанный с выделением или поглощением скрытых теплот. Этот вид перехода, как правило, связан со скачком каких-либо параметров. Примером такого перехода может служить изменение периода кристаллической решетки. Другой пример – превращение ферромагнетика в парамагнетик в точке Кюри.
Фазовым переходом второго рода называется переход, не связанный с выделением или поглощением скрытых теплот. Этот вид перехода, как правило, связан со скачком каких-либо параметров. Примером такого перехода может служить изменение периода кристаллической решетки. Другой пример – превращение ферромагнетика в парамагнетик в точке Кюри.
Конденсированные тела разделяются по физическим свойствам на аморфные и кристаллические. Аморфные тела характеризуются беспорядочным расположением частиц (атомов или молекул), что приводит к так называемой изотропности, не имеют определенной температуры плавления, поэтому их причисляют к очень вязким жидкостям.
Твердыми называются кристаллические вещества, характеризующиеся правильным расположением частиц, из которых они построены. Характерной чертой кристаллов является анизотропность. Например, теплопроводность, модули упругости, коэффициенты расширения, магнитные, электрические и оптические свойства по разным направлениям в кристаллических телах могут быть различными.
По характеру сил взаимодействия частиц кристаллы можно разделить на четыре типа: атомные, ионные, молекулярные и металлические. Остановимся на особенностях строения металлических кристаллов. Многочисленные исследования показали, что в узлах кристаллической решетки металлов расположены положительные ионы, между которыми движутся свободные электроны. Они притягиваются положительными ионами и не могут свободно покинуть металл. Однако в пределах решетки электроны могут свободно перемещаться, участвуя в хаотическом движении.
Таким образом, в грубом приближении металлический кристалл можно представить в виде решетки из положительных ионов, наполненной электронным газом. Металлы являются поликристаллами, т. е. состоят из множества отдельных кристалликов. Несмотря на то что каждый. элементарный кристаллик металла анизотропен, в целом кусок металла не проявляет анизотропности ввиду беспорядочного расположения отдельных кристаллов.
При плавлении кристаллические тела претерпевают фазовый переход первого рода, поскольку для разрушения кристаллической решетки требуется дополнительная энергия в виде теплоты плавления.
Для фазовых переходов первого рода можно рассчитать изменение энтропии по формуле Клаузиуса.
В нашем случае  (l – удельная теплота плавления; m – масса тела). Знак (+) соответствует поглощению телом количества теплоты (плавлению), знак (-) – кристаллизации, которая сопровождается выделением количества теплоты.
(l – удельная теплота плавления; m – масса тела). Знак (+) соответствует поглощению телом количества теплоты (плавлению), знак (-) – кристаллизации, которая сопровождается выделением количества теплоты.
Следует отметить, что рассматриваемый нами процесс (плавление или кристаллизация) происходит в незамкнутой системе, так как тепло подводится извне или отнимается у исследуемого тела. Поэтому изменение энтропии может иметь как положительное, так и отрицательное значение. При плавлении твердого тела изменение его энтропии положительно. Это показывает, что энтропия жидкости больше, чем твердого тела:  .
.
Известно, что энтропия связана со статистическим весом:  (формула Больцмана). Статистический вес, в свою очередь, непосредственно зависит от характера движения микрочастиц, составляющих данную систему (атомов, молекул и т. д.), и, в частности, от числа их степеней свободы. При переходе системы из состояния с меньшим к состоянию с большим числом степеней свободы статистический вес, а следовательно, и энтропия системы увеличиваются. При плавлении кристаллического тела происходит как раз такое увеличение числа степеней свободы частиц, составляющих решетку. Действительно, в кристаллической решетке ионы могут совершать только колебательное движение, другими словами, имеют лишь колебательные степени свободы. При плавлении частицы приобретают возможность двигаться поступательно, что соответствует увеличению числа степеней свободы.
(формула Больцмана). Статистический вес, в свою очередь, непосредственно зависит от характера движения микрочастиц, составляющих данную систему (атомов, молекул и т. д.), и, в частности, от числа их степеней свободы. При переходе системы из состояния с меньшим к состоянию с большим числом степеней свободы статистический вес, а следовательно, и энтропия системы увеличиваются. При плавлении кристаллического тела происходит как раз такое увеличение числа степеней свободы частиц, составляющих решетку. Действительно, в кристаллической решетке ионы могут совершать только колебательное движение, другими словами, имеют лишь колебательные степени свободы. При плавлении частицы приобретают возможность двигаться поступательно, что соответствует увеличению числа степеней свободы.
Отрицательное изменение энтропии, наоборот, указывает на уменьшение числа степеней свободы частиц системы во втором состоянии по сравнению с первым. Подобное изменение наблюдается при отвердевании жидкости.
Date: 2015-11-15; view: 627; Нарушение авторских прав