
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

III. Операционно-познавательный этап
|
|
Ожидаемые результаты: приобретение учащимися знаний, умений и навыков в рамках изучаемой темы.
Деятельность учителя: учитель излагает учащимся информацию о многообразии органических соединений, особенностях их строения и представления этого строения в виде формул.
Материалы для учителя
Атомный номер углерода 6. Относительная атомная масса 12. Это значит, что ядро атома углерода содержит шесть протонов и шесть нейтронов, электронная оболочка – шесть электронов. Электроны располагаются на двух энергетических уровнях. Первый включает два электрона и является завершенным. На втором, внешнем энергетическом уровне атома углерода четыре орбитали, на которых располагаются четыре электрона.
Обратите внимание на уникальную особенность атома углерода: число электронов на внешнем энергетическом уровне равно числу орбиталей. Кроме углерода, таким же свойством обладает атом только одного химического элемента – водорода.
Так как в атоме углерода внешний энергетический уровень заполнен ровно наполовину – четыре валентных электрона занимают четыре орбитали, атому невыгодно как отдавать, так и принимать электроны. Единственный выход – обобществлять их с такими же атомами, то есть образовывать ковалентные связи.
Известны соединения, которые включают сотни и даже тысячи атомов углерода, связанных между собой ковалентными связями. Поскольку валентность углерода равна четырем, каждый атом может быть как звеном линейной цепи, так и точкой разветвления, поэтому цепь из атомов углерода (углеродный скелет) может быть, как линейной, так и разветвленной:



Никакой другой элемент не обладает подобным свойством. Для сравнения, цепочки из атомов кремния могут включать только до 10 атомов Si. Одной из причин невысокой устойчивости ковалентных связей между атомами кремния является их бόльшая длина, по сравнению с длиной связи углерод–углерод. Это связано с бόльшим, чем у углерода радиусом атома кремния. К тому же, чем выше длина связи, тем ниже ее прочность.
Атомы углерода, составляющие цепь, могут соединяться между собой двойными и тройными связями, цепочки могут замыкаться в циклы:

Атомы углерода связанные между собой ковалентными связями, способны образовать бесчисленное множество структур, которые можно представить как «каркасы» молекул. В составе этих молекул присутствуют атомы других неметаллов, в первую очередь, атомы водорода, кислорода и азота.
Атом водорода, проявляющий валентность, равную I, легко образует ковалентную связь с атомом углерода. Соединения углерода с водородом называются углеводородами. Известно огромное число углеводородов. В принципе, возможное число таких соединений даже трудно оценить, поскольку длина углеродных цепочек весьма значительна, возможны цепочки с двойными и тройными связями между атомами углерода, разветвленные и циклические структуры. В каждой из этих структур свободные валентности заняты атомами водорода, и каждая возможная структура отвечает реальному углеводороду:


Очевидно, что число только углеводородных структур практически неисчерпаемо. Помимо водорода, углерод может образовывать ковалентные связи с атомами других неметаллов, например, кислорода и азота. Этот фактор делает число органических соединений практически безграничным:


Органические соединения, молекулы которых включают атомы кислорода, называются кислородсодержащими; азота – азотсодержащими.
Таким образом, уникальная способность атомов углерода образовывать ковалентные связи между собой приводит к возможности существования множества соединений, в состав молекул которых входят атомы водорода, кислорода, азота, галогенов, серы, фосфора и других химических элементов.
Предметом органической химии является изучение соединений на основе углерода. В школьном курсе изучаются, в основном, углеводороды, кислородсодержащие и азотсодержащие органические соединения.
Структурные формулы – язык органической химии. Пространственное строение молекул простейших органических соединений
Атом углерода имеет четыре валентных электрона, атом водорода – один. Валентные электроны можно наглядно отобразить при помощи электронных формул, в которых валентные электроны изображены в виде точек вокруг атомов:

Очевидно, что один атом углерода может образовать четыре ковалентные связи с четырьмя атомами водорода:

При этом атомы дополняют свои электронные оболочки до завершенных, углерод – до восьмиэлектронной, водород – до двухэлектронной.
Приведенная электронная формула отражает структуру молекулы метана CH4, в которой центральный четырехвалентный атом углерода связан с четырьмя одновалентными атомами водорода посредством электронных пар. На практике при отображении структуры молекулы гораздо удобнее электронную пару заменять черточной, соединяющей атомы, образующие ковалентную связь. Такие формулы называются структурными формулами.
Структурные формулы – химические формулы, отражающие последовательность связывания атомов в молекуле химического соединения.
Напомним, что формулы, отражающие только состав соединения, называются молекулярными.
Для метана, молекулярная формула которого СН4, структурная формула выглядит следующим образом:

Структурные формулы не показывают пространственного строения молекулы. Глядя на эту формулу, можно подумать, что молекула метана является плоской и имеет крестообразную форму. На самом деле это не так. Установлено, что молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а в вершинах – атомы водорода:

Угол между связями в молекуле метана равен углу между осями правильного тетраэдра и составляет величину 109о28¢.
В структурной формуле метана связи обычно изображают под углом 90о. Возможны и другие варианты, например:

Все эти варианты написания структурных формул являются правильными, так как отображают последовательность соединения атомов в молекуле. Для изображения пространственного строения молекул существуют специальные методы, которые изучаются в более подробных курсах органической химии.
Пространственное строение молекул органических соединений можно наглядно проиллюстрировать с помощью шаростержневых моделей. Моделями атомов углерода являются шарики черного цвета с четырьмя отверстиями, атомов водорода – шарики белого цвета с одним отверстием. Модели ковалентных химических связей – пластмассовые стержни. На рисунке показаны шаростержневые модели молекул метана и этана.


Рис. Шаростержневые модели молекул метана и этана.
Для демонстрации пространственного строения молекул органических соединений можно использовать модели молекул, построенные в редакторах ACDLabs, ChemOffice и других.
Итак, мы рассмотрели структурную формулу и пространственное строение молекулы простейшего органического соединения – метана. Метан представляет собой бесцветный горючий газ без запаха, нерастворимый в воде. Температура кипения метана очень низка и составляет –162 оС. Метан является основным компонентом природного газа. Кроме этого, он встречается в месторождениях каменного угля, и его внезапные выбросы бывают причиной пожаров в шахтах. Отсюда происходит название метана «рудничный газ». Выделения метана наблюдаются на торфяных болотах, этим обусловлено еще одно его название – «болотный газ».
В основе химического соединения углерода и водорода может лежать цепочка, включающая два атома углерода, структуру которой можно отобразить следующей электронной формулой:

Электронная и структурная формулы соответствующего углеводорода, этана, следующие:

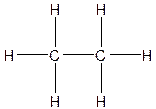
Этан, как и метан, – бесцветный горючий, нерастворимый в воде газ, имеющий температуру кипения –89 оС. Этан встречается в природе в составе природного газа.
Молекулярная формула этана С2Н6. В органической химии используются, в первую очередь, структурные формулы. Для того чтобы они не были слишком громоздкими, отдельные связи С–Н в них не указывают. В этом случае сокращенная структурная формула этана будет выглядеть гораздо компактнее: СН3–СН3. Такие сокращенные структурные формулы обычно называют просто структурными формулами.
Цепочка из атомов углерода может включать три атома углерода. Она входит в состав углеводорода, который называется пропан. Структурная формула пропана: СН3–СН2–СН3. Обратите внимание на то, что второй атом цепочки связан с двумя соседними атомами углерода, поэтому число атомов водорода, связанных с ним, только два. Молекулярная формула пропана С3Н8. Пропан, также как метан и этан, является бесцветным горючим газом, входит в состав природного газа.
Деятельность учащихся: участвуют в изучении нового материала. Можно предложить отдельным учащимся собрать шаростержневые модели молекул воды, аммиака, диоксида углерода, метана, этана.
Date: 2015-11-15; view: 949; Нарушение авторских прав