
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Молекулаішілік тотығу–тотықсыздану
|
|
Құрамындағы элементтің тотығу дәрежесі жоғарғы мәніне ие болатын болса, қосылыс тотығу-тотықсыздану реакцияларында тек тотықтырғыш ретінде қатысады да, элементтің тотығу дәрежесі төмендейді. Құрамындағы элементтің тотығу дәрежесі төменгі мәніне ие болса, тек тотықсыздандырғыш болады, бұнда элементтің тотығу дәрежесі өседі. Егер элемент аралық тотығу дәрежесін көрсетсе, онда оның атомдары жағдайға байланысты электрондарды қосып алады немесе береді. Бірінші жағдайда элементтің тотығу дәрежесі төмендейді, ал екіншісінде – өседі. Сондықтан құрамында тотығу дәрежесі аралық элементі бар қосылыстар тотығу-тотықсыздану екіжақтылығын көрсетеді, реакцияға тотықтырғышпен де, тотықсыздандырғышпен де түсуге қабілеттері бар.
Мысалы, азот қосылыстарында тотығу дәрежесін –3 (аммиак және оның тұздары) + 5 (азот қышқылы және оның тұздары) дейін өзгерте алады. Аммиак құрамындағы азот тек тотықсыздандырғыш, ал азот қышқылындағы азот тек тотықтырғыш ретінде әрекеттеседі. Құрамындағы азоттың тотығу дәрежесі +3 болатын азотты қышқыл НNО2 және оның тұздары реакцияда күшті тотықтырғышпен де, күшті тотықсыздандырғышпен де әрекеттеседі. Бірінші жағдайда НNО2 азот қышқылына дейін тотығады, ал екіншісінде - әдетте азот диоксидіне NО дейін тотықсызданады. Азотты қышқылдың тотығу-тотықсыздану екіжақтылығын келесі мысалдар арқылы көрсетуге болады:
5 KNO2 + 2 KMnO4 + 3 H2SO4 = 5 KNO3 + 2 MnSO4 + K2SO4 + 3 H2O;
2 HNO2 + H2S = 2 NO + S + 2 H2O.
Азотты қышқылдан басқа тотығу-тотықсыздану екіжақтылық қабілетін күкірт, йод, сутек пероксиді және басқа қосылыстар көрсетеді.
Құрамында тотығу дәрежесі аралық элементі бар заттар тағы бір ерекше қасиет көрсетеді. Белгілі жағдайда бұндай заттар құрамындағы элементтердің бір бөлігі тотығады, ал екінші бөлігі – тотықсызданады. Айтылған үрдіс өзіндік тотығу – өзіндік тотықсыздану деп аталады. Мысалы, хлор сумен әрекеттескенде тұз және хлорлылау (HСlO) қышқылдарының қоспасы алынады:
Cl2 + H2O = HCl + HClO.
Бұнда хлор тотығады және тотықсызданады:
Cl2 + 2 H2O - 2ē = 2 HClO + 2 H+ (тотығу);
Cl2 + 2ē = 2 Cl- (тотықсыздану).
Өзіндік тотығу – өзіндік тотықсыздануды диспропорциялану деп атайды. Кейбір күрделі заттар белгілі жағдайларда (әдетте қыздырғанда) молекула-ішілік тотығу – тотықсыздануға ұшырайды. Осындай үрдісте заттың бір құрамдас бөлігі тотықтырғыш, ал екіншісі - тотықсыздандырғыш, кызметін атқарады.
Молекулаішілік тотығу - тотықсызданудың мысалы ретінде термиялық диссоциациялану үрдістерін қарастыруға болады. Мысалы, су буының термиялық диссоциялануы нәтижесінде
2 H2O = 2 H2 + O2,
оттек тотығады (оның тотығу дәрежесі –2-ден 0-ге дейін өседі), ал сутек тотықсызданады (оның тотығу дәрежесі +1-ден 0-ге дейін кемиді). Зертханада таза азот алу үшін қолданылатын аммоний нитритінің айрылу реакциясында
NH4NO2 = N2 + 2 H2O
NН4+ ионы тотығады, ал NО2- ионы бос күйіндегі азотқа дейін тотықсызданады.
Комплексті қосылыстар
Комплексті қосылыстар бейорганикалық химияның әралуан тобына жатады. Көптеген комплекстік қосылыстар - В12 дәрумені, гемоглобин, хлорофилл физиологиялық және биохимиялық процестерде басты роль атқарады.
Комплексті қосылыстарды қасиеттері мен кеңістіктік құрылысын зерттеу кристаллохимияға көп жетістіктер әкелді. Сонымен қатар, аналитикалық химияда кеңінен қолданылады.
Комплексті қосылыстардың зерттеудегі негізін салушы Альфред Вернер (1898) болды. Одан басқа Л.А. Чугаев, И.И. Черняев, А.А. Гринберг, В.В. Лебединский осы бағытта жұмыс істеді.
Ең алғаш Л.А. Чугаев комплексті қосылыстарға мынадай анықтама берген. Комплексті қосылыстар – жеке түрде кездесетін қарапайым заттардың қосылуынан түзілетін күрделі заттар. Мысалы: жеке түрде бар барлық валенттілігі қаныққан кобальт ионы кіретін СоСl3 заты өзіне бірден алтыға дейін NH3 молекуласын қосып алады CoCl2 · 6NH3. KCN мен Fe(CN)3 тұздары да күрделі қосылыс түзеді Fe(CN)3· 3KCN.
Комплексті қосылыстар, тек молекулалардың өзара әсерлесу нәтижесінде түзілген десек, онда су ертінділерінде осы заттарды құрайтын иондар анықталуы керек. Бірақ іс жүзінде, олай болмаған Fe(CN)3· 3KCN еріткенде, химиялық анализ ертіндіде Fe3+ және CN – иондарының бар екендігін көрсетпеген. Ендеше одан мынадай қортынды шығады:
а) комплекс түзілгенде оны құраушы компоненттердің қасиеттері түгел байқалмайды.
б) комплекс құрылысы күрделі.
1893 ж. Швейцарияның химигі Альфред Вернер (1896–1913) комплексті қосылыстарының құрылысын және кейбір қасиеттерін түсіндіретін координациялық теориясын ұсынды.
Вернердің координациялық теориясының негізгі қағидалары:
1. Комплексті қосылыстар «Орталық құрылысты» болып келеді, әрбір комплексті ионда орталық атом болады, оны координацияланған иондар мен молекулалар қоршайды.
2.Көптеген элементтер екі типті валенттілік көрсетеді:
а) негізгі валенттілік (-) сызықшамен белгіленеді (тотығу дәрежесі)
ә)қосымша валенттілік(----) пунктирмен белгіленеді (координациялық сан)
б) Вернер айтуы бойынша қосымша валенттілік комплексті қосылыс түзілуі кезінде қанығады.
в) Ал Ме+n катионының негізгі валенттілігі теріс зарядталған иондармен қанықса, қосымша валенттілігі теріс зарядталған иондармен және бейтарап молекулалармен қанығады.
3. Әр комплекстің орталық атомы сыртында қанша атомдар, иондар немесе молекулалары орналасатынын көрсететін координациялық санымен сипатталады. Координациялық санының (КС) жоғары және кіші мәні болады.
Мысалы: [Ag(NH3)2]OH КС = 2
[Al(H2O)6]Cl3 КС = 6
кейбір жағдайларда координациялық сан өте жоғары мәнге ие болады. Аз
таралған элементтер КС=12 тең, ал кейде ауыспалы болып келеді.
Мысалы: Сu (ІІ) комплексінде КС= 4, 5,6.
4. Орталық атом мен ішкі сфера комплекс ядросын құрайды, формулада квадрат жақшамен белгіленеді. Комплекс ядросы бейтарап, оң және теріс зарядталған болады.
Мысалы:
 | |||
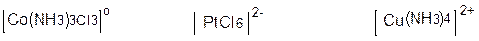 |
5. Негізгі және қосымша валенттілік бойынша координацияланған атомдар комплексті қосылыстың ішкі сферасында орналасады. Олар аддендалар (немесе лигандалар) деп қазіргі номенклатура бойынша аталады.
6.  Егер комплексті қосылыстардың ядросы зарядталған болса,онда комплекстің сыртқы сферасы болады,себебі зарядталған комплекс қарама-қарсы зарядталған ионды тартады.
Егер комплексті қосылыстардың ядросы зарядталған болса,онда комплекстің сыртқы сферасы болады,себебі зарядталған комплекс қарама-қарсы зарядталған ионды тартады.
[Co+3(NH3)6]+33Cl-
Комплекс ядросы мен сыртқы сфера арасында иондық байланыс,сондықтан
ертіндіде комплекс бірнеше ионға ыдырайды, яғни  ерітіндіде 4 ион береді.
ерітіндіде 4 ион береді.
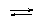 [Co(NH3)6]Cl3 [Co(NH3)6]+3 + 3Cl¯
[Co(NH3)6]Cl3 [Co(NH3)6]+3 + 3Cl¯
Мұндай диссоциацияға комплекс ядросы ұшырамайды, бірақ Ктұрақсыздық сәйкес аз да болса диссоциацияға ұшырайды.
Вернер бойынша комплекс ядросындағы негізгі және қосымша валенттілік тұрақтылығы және табиғатында айырмашылық жоқ. Мысалы, NH4+ ионындағы төрт сутек иондарының орталық азот атомымен орналасуы да, байланыс тұрақтылығы да бірдей, ал [PtCl6]2 комплекс ионында алты хлор ионының ролі мен қасиеттері бірдей.
Кей жағдайда орталық атом немесе ионның лиганда арасындағы қосымша валенттілік бойынша түзілген байланыс тұрақтылығы негізгі валенттілік түзген байланысқа қарағанда жоғары болады.
Мысалы, СоСl3+6NH3→[Co(NH3)6]Cl3 осы реакцияда Со3+ ионы негізгі валенттілік бойынша байланысқан Cl ионы комплексті суда еріткенде тез үзіледі және AgNO3 ерітіндісімен әсер еткенде Cl ионын анықтауға болады. Ал [Co(NH3)6]3+ ионындағы координацияланған NH3 молекуласы күшті қышқылдар болса да бейтараптанбайды.
Вернер теориясының жетістігі – сол кездегі комплексті қосылыстар туралы мәліметтерді қолдана отырып, оған дұрыс бағыт берді. Ал кемшілігі, координациондық теорияны ұсынса да, қосымша валенттілік табиғатын, орталық атоммен аддендалардың координациялануын түсіндіре алмады.
7. Қосымша валенттілік кеңістікте белгілі бағытта орналасады. CoCl3·6NH3 мұнда молекула қосымша валенттілікпен металл атомымен тікелей байланысып,металдық координациялар сферасын түзеді. КС = 6 СО+3 ионы алты NH3 молекуласымен қоршалғандықтан, Cl¯ ионы координациялық сфераға кірмейді. Ол Ме ионынан алысырақ орналасып,онымен әлсіз байланысқан.Сонда комплекс формуласында [Co(NH3)6]Cl3 хлор ионы әлсіз байланысқандықтан, сапалық реакцияны Ag+ немесе AgNO3 қосып дәлелдейді. Комплексті қосылыстар түзілгеннен кейін негізі және қосымша валенттіліктер айырмашылығы жойылады.
Осы зерттеулер нәтижесінде қазіргі кезде мынандай анықтама беріледі:
Қатты күйде кристалдық тор түйінінде болатын комплекс иондары ерігенде де сақталатын қосылыстарды комплекстер дейді.Комплексті қосылыстар туралы көптеген мәліметтердің пайда болуы осы реттес құбылыстарды жүйелеуге әкелді. Барлық бейорганикалық қосылыстар І-ші және жоғарғы ретті болып бөлінеді:
1- ші ретті қосылыстарға бинарлы және құрылысы бойынша қарапайым қосылыстар жатқызылды (H2O, SO3, NaCl, PCl3)
Жоғарғы ретті қосылыстарға І-ші ретті қосылыстардың әрекеттесуінен пайда болатын қосылыстар (H2SO4, CuSO4, CuSO4·5H2O, CuSO4·4NH3).
Молекулалық қосылыстар тобына келесі типтегі қосылыстар жатады:
1) гидраттар (H2SO4, Ca(OH)2).
2) кристаллогидраттар (Na2SO4·10H2O, CaCl2·6H2O).
3) аммиакты қосылыстар (CuSO4·4NH3, CoCl2·6NH3).
4)полиқосылыстар (Na2Sn типтегі полисульфидтер, KI типтегі полийодтар,
Na2Cr2O7 типтегі полихроматтар).
5)қос тұздар (3NaCl·AlCl3, KCl·MgCl2, CuCl·HCl).
6)әртүрлі комбинация класындағы молекулалық қосылыстар (K2SO4·Al2(SO4)3, CuCl2·HCl·3H2O).
7) комплекстік қосылыстар [Co(NH3)4]SO4, K3[Al(OH)6].
Сондықтан да комплексті қосылыстар деген атау тек өте тұрақты болып келетін қосылыстарға берілді.
Вернерге дейінгі теориялар химиядағы эксперименттік және теориялық зерттеу әдістерінің нашар дамуына байланысты негізгі және қосымша валенттілік табиғатын түсіндіре алмады. Бірақ Вернер комплексті қосылыстарды зерттеудің өз жолын тапты.
Комплексті қосылыстардың теориялық анализін зерттеудегі негізгі құралы изомерия болды. Изомерия - құрамы бірдей, құрылысы мен қасиеттері әртүрлі қосылыстарды атайды.Координациялық саны алтыға тең алты конфигурациялы комплекстерді қарастыра отырып, Вернер көптеген жетістіктерге жетті. Оның айтуынша комплекстердің үш ықтималдық құрылысы бар:
а) аддендалар жазық алтыбұрыштың бұрышында орналасады.
 |
ә) тригональды призмада аддендалар орналасады.
 |
б) октаэдр бұрышында аддендалар орналасады.
 |
Сонымен қатар, Вернер және олардың қаламдастары қосымша валенттіліктің табиғатын әртүрлі сандағы аддендалардың орталық атомды координациялануын аса дұрыстап түсіндіре алмады. Вернер теориясының әсерімен Льюис пен Сиджвиктің көмегімен координациялық (донорлы - акцепторлы) байланыс электрон жұбының қатысуымен жүретіні, оны, яғни электрон жұбын металл ионына Ме+n лиганда беретіні анықталды.
Координациондық немесе донорлы – акцепторлы байланыс.
Координациондық байланыс донор және акцептор қасиеттері бар бөлшектер байланысқа түскенде пайда болатынын білеміз. Акцептор қасиетін электрофильдік қабілеті бар, яғни электрондарды қосып алушы атомдар, иондар және молекулалар сипаттайды. Көптеген жағдайда оларға электрондық қабаты толық аяқталмаған атом немесе иондар жатады.
Мысалы, Н+ протоны тек қана акцептор бола алады, донор қатысында химиялық байланыс түзіп, электрон дефицитін толтырады. Донор функциясын әр түрлі қосылыстар атқара алады.
Мысалы: H+ + H2O → H3O+
гидроксоний ионы
H+ + NH3 →NH4+
аммоний ионы
 Бөлінбеген электрон жұбы бар Н2О, NH3 молекулалары келесі түрде байланысады.
Бөлінбеген электрон жұбы бар Н2О, NH3 молекулалары келесі түрде байланысады.
Ковалентті екі электрондық байланыстан айырмашылығы, координациондық байланыста жұп электронды донор ғана бере алады. Екінші қосылыс– акцептор, ол электрон жұбына бос орбиталь дайындайды.
Донорлы–акцепторлы байланыс арқылы түзілген қосылыстар бейорганикалық химияда сан алуан.
Донорлы– акцепторлы байланыстың ковалентті байланыстан айырмашылығы оның иондық сипатында. Электрон жұбының әсерінен донорлы – акцепторлы байланыс пайда болуына байланысты, акцептор теріс, ал донор оң зарядталады. Сондықтан донорлы – акцепторлы байланыс көбіне бағдаршамен донордан акцепторға бағыттайды.
 |
Координациондық байланыстың ковалентті байланыс сияқты σ және π байланыстары бар.
Координациондық σ – байланыс. Координациондық σ – байланыстың пайда болуы үшін – донор бөлінбеген электрон жұбын өзіне сәйкес орбитальға орналастыруы керек, яғни төменгі энергиялы және байланыс түзу қабілеті, ось симметриясы бар акцептордың бос орбиталімен қаптасуы қажет. Донор - NH3 , акцептор ВF3.
NH3 молекуласы пирамида төбесінде бөлінбеген электрон жұбы бар пирамидалы молекуладан тұрады.
 |
Ал BF3 байланысқа түскенге дейін жазық, тең қабырғалы үшбұрыш, оның ортасында бор,жан- жағында фтор атомдары орналасқан. В – F үш байланыстары бірдей және орталық атом бордың 2s, 2px, 2py электрондарының гибридті орбитальдарының F атомы 2р – электрондарымен қаптасуы нәтижесінде пайда болады. Ал бордың рz орбиталі ВF3 молекуласының жазықтығына перпендикуляр, вакантты болып келіп, яғни электроны жоқ, гибридтенуге қатыспайды.
Бордың 2рz бос орбиталінде электрон пайда болғанда, BF3 молекуласы пирамида түріне көшеді.

Себебі, ВF үш байланыстың электрондары жаңа екі электронды донорлы – акцепторлы байланыстан тебіледі де, жазықтықта тетраэдр түрінде орналасады.
Яғни, донорлы – акцепторлы байланыс екі sp3 – гибридті орбиталінің қаптасуы нәтижесінде пайда болады, оның біреуінде электрон жұбы бар – донор, ал екіншісі бос болады. Мұнда донорлы – акцепторлы байланыста ось симметриясы бар, яғни σ – байланыс болып келеді.
Донорлы – акцепторлы байланыс түзілу барысында электрон тығыздығы NH3 және BF3 қайта таралады. Азотта оң, ал борда теріс заряд пайда болады.
H3N→BF3 немесе H3N+→ -BF3
Координациондық π – байланыс. Зерттеулер нәтижесі N(CH3)3 триметиламин құрылысы пирамида, NH3 сияқты, ал N(SiH3)3 трисилиламиндікі жазық, тригональді екенін көрсетті.
Екінші қосылыстың мұндай болуы трисилиламиндегі донорлы – акцепторлы байланыс пайда болуымен және ондағы π – байланыстың болуымен сипатталады.
NH3 және N(CH3)3 – дегі бөлінбеген электрон жұбы болуы басқа үш электрон жұптарының тебілуіне және конфигурациясы пирамидальді sp3 – гибридті байланысқа әкеледі. Ал N(SiH3)3 құрылысы жазық болғандықтан, азот атомындағы бөлінбеген электрон жұбы делокальданған.
Азот атомының делокальдануы келесі түрде болады: азоттың 2s, 2px, 2py орбиталі sp2 – гибридтенуге түседі де, бір – бір электрондарын σ – байланыс түзуге қатыстырады, олар кремнийдің бір sp3 орбиталімен қаптасады. Азоттың 2pz орбиталі, яғни бөлінбеген электрон жұбы бар орбиталі гибридтенуге қатыспайды. Ол pz орбиталға сәйкес кеңістікте орналасып кремнийдің d - орбиталімен π – симметриялы байланыс түзеді. Азоттың 2pz- орбиталінің кремнийдің бос 3d – орбитальдарымен қаптасуы кремнийдің үш атомымен азоттың атомы арасындағы кеңістікте азоттың электрон жұбының делокалдануына әкеледі.

 | ||||||||||
 | ||||||||||
 | ||||||||||
 | ||||||||||
 |  | |||||||||





Үш бірдей кремний атомы өзінің бос 3d – орбиталіне азоттан тек бір жұп электронын алады, NSi әр байланысына 1/3 π байланыс сәйкес келеді. Сондықтан NSi байланысы бір π және 1/π байланыстан тұрады. Яғни, π – электрондар молекула бойы түгел таралған, делокальданған. Осыған байланысты σ – орбиталь sp2 – гибридті электрондардың тебілуі нашар (әлсіз) болып келеді, сол себепті N(SiH3)3 молекуласы жазық болады.
Комплексті қосылыстар құрылысы.
Комплексті қосылыстар ішкі және сыртқы сфералардан тұрады
Мысалы, [Co(NH3)6]3+Cl3¯.
Квадрат жақша ішіндегі атомдар тобы [Co(NH3)6]3+ ішкі сфера немесе комплекс ионы, Сl¯ иондары – сыртқы сфера болады.
Ішкі сферадағы орталық атом немесе (ион) комплекс түзуші (Co3+), ал маңына координацияланған молекулалар, иондар – лигандалар. Комплекс түзушілер – кейбір металл еместер атомдары (N, Cl) және негізінен Д.И.Менделеевтің периодтық жүйесіндегі қосымша топша элементтерімен кейбір негізгі топша элементтері (Be, Al, Sn, Pb, As, Sb).
Лигандалар типтеріне қышқылдар аниондары, ОН¯ иондар, молекулалар, күрделі органикалық молекулалар жатады.
Комплекс түзушілердің координациялық саны элемент валеттілігіне тең.
Кейбір элементтердің координациялық саны өзгереді. Лигандалар көпшілігі жұптасқан электрондары болғандықтан, полюсті немесе оңай полюстенетін молекулалар. Мұндай қосылыстар электрондарын бере алатындықтан (донор) орталық атоммен байланыс түзуге мүмкіндігі бар.
Сондықтан,орталық атомға беретін электрон жұптарының санына байланысты, лигандаларды монодентатты, бидентатты, тридентатты, тетрадентатты, полидентатты деп бөлінеді. Монодентатты лигандалар металдың атомына бір ғана электрон жұбын береді. Бұл типке NO2¯, F¯, Cl¯, Br¯және H2O, NH3, CO, NO жатады.Бидентатты – екі электрон жұбын береді, яғни екі электронды донорлық байланыс түзе алады. Бұл типке ¯OOC COO¯, H2NCH2CH2NH2 жатады.
Полидентатты екі немесе үш донорлық байланыспен координацияланады
 |
мұндай құрылымды комплекстер хелаттар деп аталады.
Комплексті қосылыстардың жіктелуі.
Координациялық қосылыстарды диссоциациялану тұрғысынан лигандалар табиғатына байланысты, комплекс ионының зарядына байланысты және комплекстің ішкі құрылысы, яғни, комплекс түзуші ион саны бойынша мынадай типтерге бөледі.
1. Диссоциация тұрғысынан:

 бейэлектролиттер [Pt+2(NH3)20Cl2¯]0
бейэлектролиттер [Pt+2(NH3)20Cl2¯]0
комплекс
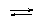

 қышқылдар
қышқылдар
H[AuCl4] H++[AuCl4]-

 электролиттер негіздер
электролиттер негіздер
 [Ag(NH3)2]OH [Ag(NH3)2]++OH¯
[Ag(NH3)2]OH [Ag(NH3)2]++OH¯
 тұздар
тұздар
 K2[HgI4] 2K++[HgI4]2
K2[HgI4] 2K++[HgI4]2
2. Комплекс ионына кіретін лигандалар табиғаты бойынша:

 аквакомплекстер [Co(H2O)6]SO4
аквакомплекстер [Co(H2O)6]SO4
 аммиакаттар [Cu(NH3)4]SO4
аммиакаттар [Cu(NH3)4]SO4
комплекс
 ацидокомплекстер K4[Fe(CN)6]; H2[SiF6]
ацидокомплекстер K4[Fe(CN)6]; H2[SiF6]
 гидрооксокомплекстер K3[Al(OH)6]
гидрооксокомплекстер K3[Al(OH)6]
Құрамындағы галоген ионына және галоген молекуласына байланысты:

 гомогенді
гомогенді
K[I(I2)3]; Cs[Br(Br2)]
полигалогенидтер
 гетерогенді K[ICl2]; Cs[I(Cl2)]
гетерогенді K[ICl2]; Cs[I(Cl2)]
3. Комплекс ионынының зарядына байланысты:

 Катион типті [Ag+(NH3)00]+Cl¯
Катион типті [Ag+(NH3)00]+Cl¯
 комплекс анион типті Na2+[Pt+4Cl2¯(CN)4¯]2
комплекс анион типті Na2+[Pt+4Cl2¯(CN)4¯]2
 электробейтарап [Cr+3(H2O)04PO43
электробейтарап [Cr+3(H2O)04PO43
4. Комплекс түзуші иондардың саны бойынша:

 моноядролық
моноядролық
комплекс
 екі ядролық
екі ядролық
 полиядролық
полиядролық
болып бөлінеді.
Date: 2015-11-13; view: 4493; Нарушение авторских прав