
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Валенттілік байланыс әдісі
|
|
Орталық атомның бос орбиталь саны координациялық санына тең.
1) Со3+ + 6NH3→[Co(NH3)6]3+ осы комплекстердің түзілуін қарастырайық
+27Со 1s22s22p63s23p63d74s24p0
 |
| ||||
 | |||||
…
3d7 4s2 4p0
Со+3 1s22s22p63s23p63d64s04p0 Co03e¯→Co+3
 | |||||
 |  | ||||

 …
…
 | |||||
 |  | ||||
E(Co+3)*…
Кобальт катионының валенттік қауызында төрт бос орбиталь бар. Кобальт катионын қоздыру арқылы 3d – деңгейшесіндегі жалқы электрондарды өзара жұптастырып, бос орбитальдар санын алтыға дейін жоғарылатуға болады. Жұлдызша (*) белгісі кобальт катионының қозған күйін көрсетеді. Қозған күйдегі кобальт катионының алты бос орбиталі: екі 3d, бір 4s және үш 4р орбитальдары бар.
Аталған орбитальдар байланыс түзуге қатыспастан бұрын d2sp3 - гибридті орбитальға айналады.
:NH3 аммиак молекуласының бөлінбеген электрон жұбымен вакантты орбитальға орналасып, донорлы - акцепторлы механизмі бойынша байланысады да, [Co(NH3)6]3+ катионын түзеді.
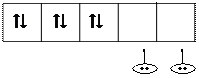 | |||||||
 |  | ||||||
 | |||||||
NH3 NH3 NH3 NH3 NH3 NH3
Кобальт катионының d2sp3 – гибридті орбитальдары октаэдр төбесіне бағытталғандықтан, түзілген комплекстің құрылысы октаэдр болады.
Сонымен, валентілік байланыс әдісі бойынша комплексті қосылыстағы орталық атом (ион) мен лиганд арасындағы байланыс донорлы – акцепторлы жолмен түзілетін коваленттік байланыс. Комплексті ионның кеңістіктегі құрылысы орталық атомның байланыс түзуге жұмсайтын бос орбитальдарының типіне байланысты. Орталық атом байланыс түзуге sp – гибридті екі орбиталін пайдаланса сызықтық, үшбұрышты sp2 – гибридті үш орбиталін пайдаланса жазық үшбұрышты, sp3 – гибридті төрт орбиталін пайдаланса тетраэдрлік, dsp2 – гибридті төрт орбиталін пайдаланса квадратты, d2sp3 – гибридті алты орбиталін пайдаланса октаэдрлік комплекс түзіледі.
Валенттілік байланыс әдісі комплексті қосылыстардағы орталық атом мен лиганд арасындағы байланыстың түзілу механизмін және комплекстердің кеңістіктегі құрылысын түсіндіре алады. Бірақ валенттілік байланыс әдісі комплексті қосылыстардың спектрді сіңіруін, π – байланыс және босатушы орбитальдар түзілуін қарастырмайды.
Кристалдық өріс теориясы.
Бұл теорияда комплекс түзуші мен лиганда арасында электростатикалық күш (иондық байланыс) деп қарастырылады. Атом ядросына байланысты бес d орбиталь кеңістікте әр түрлі орналасады.
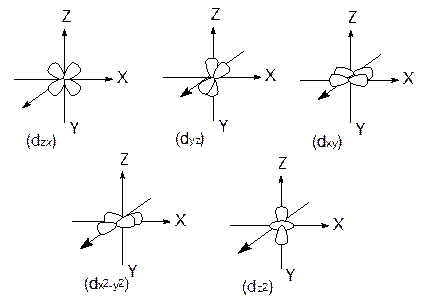
dε
dγ
Сурет 10.1. d –электрон бұлттарының кеңістікте бағытталуы.
Бос атом немесе ионда 5d - орбиталінің энергиясы бірдей, яғни олар жаңартылған. Егер d-элемент ионын бірдей таралған теріс зарядтың орталық сферасына (гипотетикалық жағдай) орналастырсақ, барлық 5 электрон бұлтына бірдей тебілу күші әсер етеді. Осы сфера мен d- электрон бір-бірінен тебіледі. Ал егер d-элементі ионы октаэдрлік қоршауға түссе, онда орталық атом координаталар жүйесінің орталығында орналасады да, лигандтар орталықтан белгілі қашықтықта координаталар осьтерінің бойына орналасады.Орталық атомның dz2,dx2y2 орбитасының электрондары лигандтарға қарай, ал dxy, dyz, dxz орбитаның электрондары лигандтар арасындағы кеңістікте орналасады.
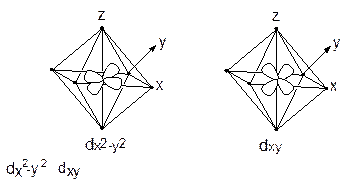 |
Сурет 10.2., орбитальдарының октаэдрлік лиганда өрісінде орналасуы.
Лигандтар теріс зарядты болатындықтан d-орбиталь (электрондары) олардан тебіледі. Нәтижесінде d-орбиталь энергиясы артады. Бірақ dx2y2,dz2 орбиталь dxy, dyz, dxz орбитальға қарағанда қатты тебіледі де, энергиясы көбірек артады. Сонымен, ион октаэдрлік қоршауға түскендіктен оның d-орбиталінің энергиялары екі топқа жіктеледі. dxy, dyz, dxz (dε) орбитальдар энергиясы dz2,dx2y2 (dγ) орбитальдар энергиясынан төмен болады.
dεdγ = Δ -жіктелу энергиясы деп аталады.
d-деңгейшесін жіктеу қабілетіне қарай лигандтар спектрохимиялық қатардеп аталып, мынадай қатарға орналасады:
CO,CN¯,NO2¯ > NH3 > NCS¯ > H2O >F¯ >OH¯ >Cl¯ >Br¯ >I¯
Қатарда әрбір лиганд өзінен соң орналасқан лигандтарға қарағанда d-деңгейшесін күштірек жіктейді.
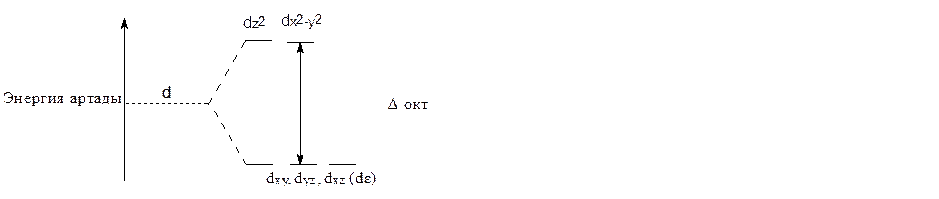
Сурет 10.3. d –деңгейдің октаэдрлік комплекстің лиганда өрісінде таралуы.
Егер ион тетраэдрлік қоршауда болса, сызбанұсқасы келесі түрде болады.
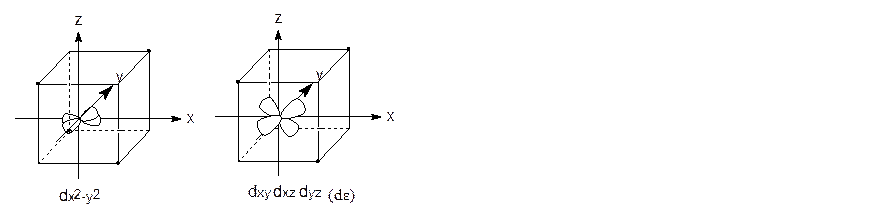
Сурет 10.4. dx2y2, dху орбитальдарының тетраэдрлік лиганда өрісінде орналасуы.

Δ тетр
Сурет 10.5. d – деңгейдің тетраэдрлік комплекстің лиганда өрісінде таралуы.
Мұнда dε - орбиталь лигандтарға жақын орналасқан, сондықтан қатты тебіледі, энергия көп болады. Демек, тетраэдрлік комплексте d-орбиталь жіктеліп октаэдрлік комплекстерде керісінше болады. Сонымен, комплекс құрамындағы ионның d-деңгейшесі жіктеледі.d – деңгейшесінің сызбанұсқасы мен энергиясы комплекстің конфигурациясына (құрылысына), лиганд пен комплекс түзушінің табиғатына байланысты болады.
Комплексті қосылыстардың магниттік қасиеттері.
Кристалдық өріс теориясы бойынша комплексті қосылыстардың магниттік қасиеттерін түсіну үшін, электрондардың жіктелген d-орбитальдарға орналасу ретін білу керек. Электрондың d-орбиталінің орналасу реті жіктелу энергиясы Δ мен электрондардың өзара жұптасу энергияларының Р шамасына байланысты болады.
1. Егер лигандтың тудыратын өрісі әлсіз болса, жіктелу энергиясының шамасы электронның жұптасу энергиясынан аз болады; яғниΔ<P.Онда барлық d-орбитальдар алдымен бір электронмен, одан соң екінші электронмен толтырылады.
2.Егер лигандтың тудыратын өрісі күшті болса, жіктелу энергиясының шамасы электронның жұптасу энергиясынан үлкен болады, яғниΔ>Pонда алдымен төменгі энергиялы орбиталь, одан соң жоғарғы энергиялы орбиталь толтырылады.
Мысалы, [CoF6]3 +27Co 1s22s22p63s23p63d74s2
Co+3 1s22s22p63s23p63d64s0
 | |||
 | |||
…
төрт жұптаспаған электрондары бар. Әлсіз өрісі бар F¯ лигандаларының октаэдрлік өрісінде, орталық ионның d-орбиталінің жіктелу энергиясында (Δ), жұп электрондарының бір-бірінен тебілуі басым болатындықтан, Хунд ережесі бойынша орналасқан.
 |
Сурет 10.6. Со3+ ионының d- электрондарының [CoF3]3-октаэдрлік комплексте таралуы.
[CoF6]3 ионында төрт жұптаспаған электрондары бар, сондықтан парамагнитті қасиет көрсетеді.
 [Co(NH3)6]3+ аммиакты комплексте жүктелу энергиясы электрондардың жұптасу энергиясынан үлкен Δ>Р, электрондар dεорбиталінде орналасады.
[Co(NH3)6]3+ аммиакты комплексте жүктелу энергиясы электрондардың жұптасу энергиясынан үлкен Δ>Р, электрондар dεорбиталінде орналасады.
Сурет 10.7. Со3+ ионының d – электрондарының [Co(NH3)6]3+ октаэдрлік комплексте таралуы.
Кристалдық өріс теориясын қолданып, қосылыс түсін түсіндіруге болады. Егер dγ деңгейшеде толмаған орбиталь болса, жарық сәулелері төменгі энергетикалық деңгейшеден,яғни dεнен dγ – ға электрондар ауыса алады. Комплекс ионының түсі осы электрон ауысуымен түсіндіріледі.
Комплекстіқосылыстарды молекулалық орбитальдар әдісі
бойынша түсіндіру.
Бұл әдіс бойынша комплекс түзуші де, лигандалар да ортақ комплекс түрінде қарастырылады. Ол үшін d-элементтердің октаэдрлік комплексінің жағдайын талқылайық.
ML6 құрамды октаэдрлік комплекстің координаталар жүйесі мынадай:
 |
Сурет 10.8. МL6 құрамды октаэдрлік комплекстің координаталар жүйесі.
d-элементтің энергетикалық жақын ns, np - сыртқы және (n1)d орбиталі валентті болып келеді. Бұрын білетіндей, әрекеттесетін бөлшектердің энергиясы жағынан жақын және кеңістікте орналасу сәйкестігіне байланысты ғана молекулалық орбиталь түзілетін. π-байланыссыз октаэдрлік комплексті қарастырайық:
 | |||
 | |||
Орталық атомның валенттілік орбиталінің және лиганда орбитальдарының
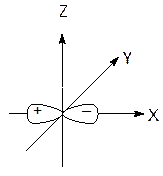
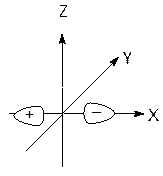
симметрияға сәйкес орналасуы мүмкін болатын σ - типті комбинация береді. Егер осыны бірінің үстіне бірін келтірсек, қаптасу көруге болады, яғни комплекс түзушінің s- орбиталі сфералық симметрияға байланысты лиганданың 6 орбитальдары бірдей қаптасады. Бұл жеті орталықты байланыстырушы және босатушы молекуланың σs орбиталін түзеді(σsбайл және σsбос). р – типті үш орбитальдар лигандалармен созылған гантель бойымен қаптасады.
 |  |
px
Сурет 10.9. Орталық атом орбиталі мен лиганда орбитальдарының сәйкес симметриясы.
Ол үшорталықты үш байланыстырушы және үш босатушы σpорбиталь (σxбайл, σyбайл, σzбайл және σxбос, σyбос, σzбос) түзеді.
dx2y2 және dz2 – типті орбитальдар лиганда орбитальдарымен олардың жапырақшаларының орналасу бағытында қаптасады.


 Соның нәтижесінде σd – орбитальді,, екі байланыстырушы және екі босатушы молекулалық орбитальдар түзеді. Қалған d орбиталінің үшеуі dxy, dyz, dzx типті орбитальдардың жапырақшалары лиганда орбиталімен комбинацияға түспейді. Сондықтан октаэдрлік комплексте π – байланыссыз болып, олар бірорталықты байланыспайтын орбиталь түзеді. Оларды πd – орбиталі (πxy, πyz және πzx) деп белгілейді.
Соның нәтижесінде σd – орбитальді,, екі байланыстырушы және екі босатушы молекулалық орбитальдар түзеді. Қалған d орбиталінің үшеуі dxy, dyz, dzx типті орбитальдардың жапырақшалары лиганда орбиталімен комбинацияға түспейді. Сондықтан октаэдрлік комплексте π – байланыссыз болып, олар бірорталықты байланыспайтын орбиталь түзеді. Оларды πd – орбиталі (πxy, πyz және πzx) деп белгілейді.
Мысалы: [CoF6]3 октаэдрлік жоғары спинді комплексті қарастырайық.
 |
Сурет 10.10. Валенттілік электрондардың [CoF6]3 октаэдрлік жоғары спинді комплекстің молекулалық орбиталында таралуы.
Осындағы 18 электронның – алтауы Со+3 ионына және 12 электроны лигандаға (6F¯) сәйкес келеді. Лиганданың барлық 12 электроны 6 байланыстырушы σ – орбитальда орналасады, яғни комплекс түзуші лигандтың 6 σ – байланысы пайда болады. Ал қалған 6 электрон π – байланыспайтын және σdбос орбиталі орналасады.
F әлсіз өріс тудырады, сондықтан электрондар Хунд ережесі бойынша бір – бірден бес орбитальға орналасады, кейін жұптасады. F лигандасының 6 ионының бөлінбеген электрон жұбының атомдық орбиталі Со3+ ионының атомдық орбиталінің электронымен салыстырғанда төмен, яғни 2р – орбиталь энергиясы 3d – орбиталь энергиясынан кіші болады.
(σsбайл)2(σрбайл)6(σdбайл)4(πd)4(σdбос)2
Бұл жерде электрондардың орбитальдарға орналасуы Δ – жіктелу энергиясы мәніне тығыз байланысты.
Электрон тығыздығының симметриялы таралуына байланысты, егер барлық үш πd – орбитальдар бір – бірден немесе екі – екіден электронмен толтырылса, ол октаэдрлік комплекс аса тұрақты болады.
Мысалы, (σбайл)12(πd)3 немесе (σбайл)12(πd)6
Ал Δ мәні кіші болса, мынадай октаэдрлік комплекс те тұрақты болады
(σбайл)12(πd)3(σбос)2.
Молекулалық орбиталь әдісі комплексті қосылыстарды валенттілік байланыс және кристалдық өріс теориясы негізінде түсіндіреді.
Date: 2015-11-13; view: 3630; Нарушение авторских прав