
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методика виконання роботи. 1. Визначення теоретичного і практичного виходу соку безперервним способом
|
|
1. Визначення теоретичного і практичного виходу соку безперервним способом. Для цього 500г плодів, що підлягають пресуванню, миють і подрібнюють. На пресування відбирають наважки в 500 г. М’язгу загортають у серветки і пресують. Частину середньої проби м’язги використовують для визначення кислотності (якщо м’язга плодова) чи масової частки сухих речовин (якщо пресують малокислотну сировину). Після закінчення пресування вичавки зважують. Далі знаходять кислотність чи масову частку сухих речовин у м’яззі, соку й вичавках. Розраховують вихід соку теоретичний та практичний.
Отримані аналітичні дані підставляють у формулу (30), розраховують вихід соку і порівнюють його з експериментальними даними. Експерименти проводять у трьох повторах, визначаючи похибку кожного досліду як відхилення від його середнього значення. Отримані дані заносять табл. 16.
2. Визначення виходу соку дифузійним способом та кінетичного показника процесу дифузії. Для цього у хімічну склянку місткістю 50 см3 вміщують наважку м’язги 20 г і заливають рівним об’ємом (20 мл) дистильованої води. Причому для отримання м’язги плоди обов’язково мають підлягати спеціальному попередньому обробленню, спрямованому на підвищенню клітинної проникності: тепловому обробленню, заморожуванню, електроплазмолізу та ін.
Через кожні 5 хв, після перемішування відбирають 2 – 3 краплі настою і поміщають на лінзу рефрактометра, реєструють відсоток сухих речовин і записують отримані дані у таблицю, аналогічну табл.18. Такі вимірювання проводять через кожні 5 хв протягом 30 хв. Потім розраховують показник d за формулою (38), визначають кількість дифузорів при настоюванні протягом певного часу за формулою (37) і добову продуктивність дифузійної батареї  за формулою (35).
за формулою (35).
Розрахувавши кількість дифузорів проводять їх експериментальну перевірку. Для цього складають батареї дифузорів (склянок або банок) відносно, приміром, 30 і 10 хв, тобто з п’яти 5 і 11 дифузорів. Далі у всі дифузори завантажують наважками по 20 г плодової м’язги. У перші дифузори наливають по 20 см3 води і починають настоювання: у батареї з п’яти дифузорів – 30 хв, в батареї з 11 дифузорів – 10 хв. Після настоювання піпеткою відбирають настій з першого дифузора й переносять його у другий, і так повторюють настоювання у кожному дифузорі – до останнього. Після закінчення настоювання в останньому дифузорі перевіряють вміст сухих речовин у рідкій фазі за рефрактометром.
У разі правильного проведення досліду вміст сухих речовин у настої з останнього дифузора має бути на 1 % нижчим, ніж у натуральному соку, вичавленому з цього виду сировини. Отримані дані заносять у табл. 17.
5. Опрацювання результатів роботи.
Після кожного етапу здійснюють відповідні розрахунки, результати яких записують у таблиці.
Таблиця 16
Теоретичний і практичний вихід соку, отриманого безперервним способом
| Сировина | Кислотність, % | Вихід соку, % | |||
| К1 | К2 | К3 | Втеор. | Впракт. | |
| … |
Таблиця 17
Залежність кількості дифузорів від часу настоювання
| Сировина | Вид оброблення сировини | Час настоювання, хв | Кількість дифузорів шт. | Загальний час настоювання, хв. | СР % | |
| екстракту | сировини | |||||
| … |
Після таблиць роблять висновок про ефективніший метод витягання соку.
Приклад виконаної даної роботи у процесі дослідження яблучної м’язги з вмістом сухих речовин 12 %, задана масова частка сухих речовин у соку дорівнює 11 %. Потрібно визначити число дифузорів, якщо настоювання у кожному проводити протягом 30 хвилин.
Для визначення кількості дифузорів спершу слід дослідити динаміку кінетичного показника у процесі настоювання яблучної м’язги. Отримані дані потрібно звести у табл. 18.
Таблиця 18
Динаміка кінетичного показника у процесі настоювання м’язги
| № досліду | Тривалість настоювання, хв | СРn, % | СРmax, % | Показник d |
| 1,8 | 0,30 | |||
| 2,5 | 0,42 | |||
| 3,1 | 0,52 | |||
| 3,6 | 0,60 | |||
| 4,2 | 0,70 | |||
| 4,56 | 0,76 |
За даними табл.1 кінетичний показник d протягом 30 хв настоювання дорівнює 0,76, тоді
 .
.
Якщо ж настоювання вести протягом 10 хв, то кінетичний показник d дорівнюватиме 0,42, а потрібна кількість дифузорів
 .
.
Отже, у разі зменшення часу настоювання у кожному дифузорі їх необхідна кількість зростає, але ще більшою мірою зростає добова продуктивність дифузійної батареї  .
.
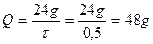 .
.
Добова продуктивність батареї з 11 дифузорів
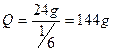 .
.
Отже, кількість дифузорів збільшилась у 2,2 рази, а добова продуктивність збільшилась у 3 рази.
Оформлення протоколу здійснюють за порядком, наведеним у дод. 1.
Запитання для самоконтролю
1. У чому полягає складність контролю роботи станції безперервного пресування рослинної м’язги?
2. На якому принципі ґрунтується аналітичний метод визначення виходу соку під час безперервного пресування?
3. Чим характеризується процес вилучення соку у дифузійних батареях?
4. Як визначити кінетичну константу процесу дифузії під час настоювання рослинної сировини у періодично діючих дифузорах?
5. Як розрахувати оптимальну кількість апаратів періодично діючої батареї дифузорів?
ЛАБОРАТОРНА РОБОТА № 13
ДОСЛІДЖЕННЯ ПРОЦЕСІВ ОСВІТЛЕННЯ ПЛОДОВИХ СОКІВ
Мета роботи: дослідити вплив різних способів освітлення на швидкість процесу, стійкість колоїдної системи соку, якість осаду, вихід і якість соку з метою встановлення найефективнішого способу освітлення соку.
Завдання на виконання роботи: освітити сік різними способами, визначити фізико-хімічні показники освітленого й неосвітленого соку і на основі отриманих результатів зробити висновок про найефективніший спосіб освітлення заданого виду соку.
1. Основні теоретичні положення
Плодові й овочеві соки містять цукри, кислоти, білки, солі, вітаміни, пектинові дубильні речовини, барвники, а також різні частинки м’якоті, шкірки й насіння, кількість яких залежить від виду, сорту, структури тканини, ступеня зрілості сировини, а також техніки отримання соку.
Соки являють собою складну полідисперсну систему, у якій дисперговані різні за величиною частинки. До неї входять:
груба дисперсна фаза з розміром частинок 100 мкм і більше – частинки плодової м’якоті, шкірка, насіння тощо видимі неозброєним оком;
тонка дисперсна фаза з розміром частинок від 100 до 0,5 мкм – подрібнені частинки целюлози, клітин і колоїди, що зазнали процесу коагуляції. Їх видно під звичайним мікроскопом. Вони перебувають у броунівському русі, спричиненому ударами молекул дисперсійного середовища;
частинки, розміром від 0,5 до 0,1 мкм. – знаходяться у броунівському русі і в зваженому стані, але їх видно тільки під ультрамікроскопом;
колоїдна система з розміром частинок від 0,1 до 0,001 мкм – білки, крохмаль, пектинові й дубильні речовини, барвники;
молекули й іони з частинками розміром від 0,001 до 0,0001 мкм – цукри, кислоти, солі й ін.
Таку полідисперсну систему, можна зруйнувати тільки прикладанням зовнішньої сили. Стійкість її залежить від дисперсності часток, характеру дисперсної фази та дисперсійного середовища. Стабільності цьому складному середовищу надає колоїдна система.
Залежно від вмісту м’якоті плодові соки поділяють на:
освітлені (кришталево прозорі), у яких зруйновано колоїдну систему і відокремлено всі суспендовані частинки (як показують дослідження для отримання прозорого соку достатньо зруйнувати 30 % всіх колоїдів);
неосвітлені (опалесцентні), у яких колоїдну систему збережено й стабілізовано, а видалено тільки суспендовану фазу;
соки з м’якоттю, у яких видалено тільки крупні зважені частинки.
З одних видів плодів та овочів готують тільки освітлені соки (виноградний), з інших – соки із м’якоттю (томатний, морквяний, абрикосовий, персиковий та ін.). З яблук, айви, груш можна отримувати освітлені й неосвітлені соки. Тому, важливо знати склад і властивості плодів та овочів, а також умови, за яких колоїди можуть коагулювати або умови їх стабілізації. Для існування гетерогенної колоїдної системи потрібні такі умови:
високий ступінь дисперсності колоїдних частинок (10-6 – 10-7 см), оскільки від розміру частинок залежить інтенсивність броунівського руху, який перешкоджає седиментації;
наявність однойменного електричного заряду у колоїдних частинок, що відштовхує їх одна від одної; у разі втрати, або зменшення заряду перевагу отримують сили взаємного притягання, у результаті чого частинки з’єднуються й під дією сили тяжіння осідають;
наявність на поверхні частинок водної оболонки, що перешкоджає їх стиканню, з’єднанню, а отже, і седиментації.
Колоїдна система в соках зумовлена переважно білками, пектиновими речовинами, крохмалем, смолами, клеями і т.д., причому перевагу мають гідрофільні колоїди, покриті гідратною оболонкою. На поверхні частинок знаходяться потенціалутворюючі іони, які здебільшого й зумовлюють електричний заряд. Колоїдна система в соках може бути зруйнована тільки за сприятливих умов для укрупнення колоїдних частинок, що в свою чергу може статися у разі втрати електричного заряду і взаємодії з іншими хімічними речовинами. Гідратна оболонка й однойменний електричний заряд гідрофільних колоїдів перешкоджають їх агрегації та випаданню в осад. Зруйнувати колоїдну систему (тобто осадити попередньо укрупнені частинки) можна:
нейтралізацією електричних зарядів колоїдних частинок додаванням колоїдів з протилежним за знаком електричним зарядом;
зневодненням і денатуруванням колоїдних частинок під час нагрівання – перетворенням золя в гель;
структурною зміною колоїдних речовин – взаємодією з хімічними речовинами чи ферментними препаратами.
Розрізняють такі методи освітлення плодових соків:
фізичні, не пов’язані зі зміною хімічного складу і колоїдних властивостей рідкої фази продукту – проціджування, центрифугування, відстоювання, електросепарування;
ферментативні, під час яких під дією природних або штучно внесених в продукт ферментів відбуваються хімічні, біохімічні, фізико-хімічні зміни соку, що ведуть до седиментації;
колоїдно-хімічні, спрямовані на руйнування колоїдної системи – різні варіанти “обклеювання”, освітлення купажуванням, термічні методи, оброблення коагулянтами, бентонітовими глинами;
хімічні ґрунтовані на взаємодії природних речовин соку між собою чи з внесеними хімічними реагентами.
Названі способи руйнування колоїдних систем широко застосовують для освітлення соків – самоосвітлення, освітлення заморожуванням, освітлення миттєвим підігріванням й охолодженням, освітлення “обклеюванням” – таніно-желатинове освітлення, освітлення глинами, залізосиньородистим калієм (К4Fe(CN)6), ферментативне освітлення (депектинізація).
Найефективніший є метод освітлення ферментними препаратами, оснований на дії ферменту пектинази, яка викликає руйнування пектину до низькомолекулярної моногалактуронової кислоти, що утворює істинний розчин. Ферментні препарати, застосовані у соковому виробництві, отримують культивуванням плісеней (Aspergillus Penicillium) на поживні середовища. Дослідженнями доведено, що під час ферментативного оброблення не руйнується вітамін С, а ферментні препарати не містять й не вносять у соки шкідливих речовин й не впливають на смак, колір, аромат. Освітлення соків ферментними препаратами здійснюється у три етапи:
дестабілізація, за якої спостерігається зниження в’язкості соку;
утворення великого шару осаду, помітного неозброєним оком;
руйнування пектину, що є гарантією проти каламутності соків і драглювання концентратів.
Оптимальну дозу засобу для освітлення даної партії соку визначають на основі пробного освітленя. Для цього спочатку перевіряють наявність в соку пектину і крохмалю за якісними реакціями: на пектин – спиртова проба, на крохмаль – йодна.
У разі перевірки на вміст пектину в пробірку місткістю 10 см3 вносять 5 см3 соку та 5 см3 етилового спирту. Вміст пробірки перемішують і залишають на 10–15 хв, а потім за утвореним згустком пектину визначають його кількість та необхідну дозу пектолітичного ферментного препарату.
Об’єм згустку,см3 Доза засобу, %
До 2 0,01
До 4 0,02
Більше 5 0,03
При йодній пробі сік нагрівають до 75-80 °С, потім охолоджують до температури 30-40 °С і відбирають 10 см3 в пробірку. До соку додають 1 см3 0,01н розчину йоду і перемішують. За інтенсивністю отриманого забарвлення суміші визначають кількість крохмалю та дозу амілолітичного ферментного засобу, (%):
Забарвлення Доза засобу, %
Темно-синє 0,006 – 0,01
Синє 0,005 – 0,004
Фіолетове 0,003 – 0,002
Правильність вибраної дози перевіряють пробним освітленням у пробірках.
Освітлення обклеюванням ґрунтується на нейтралізації зарядів колоїдів соку. Для проведення процесу обклеювання соку використовують желатин, який у розчині має позитивний заряд і нейтралізує негативні заряди пектинових колоїдів. Позбувшись заряду, пектинові молекули укрупнюються і випадають в осад. Для більшої ефективності іноді разом з желатином, як допоміжний засіб, використовують танін, який перетворює гідрофільні колоїди на гідрофобні.
Широко застосовують (особливо для яблучного соку) комбіноване освітлення ферментними препаратами й желатином. Цей метод значно прискорює процес освітлення й дає можливість отримати кришталево прозорі соки.
Освітлення бентонітовими глинами – це простий і надійний спосіб видалення білкової каламуті. Вони несуть негативний заряд, здатні до іонного обміну, мають високу адсорбційність та взаємодіють з поліфенольними речовинами з утворенням танатних комплексів. Для посилення ефективності їх часто застосовують у поєднанні з желатином, або ферментами.
2. Прилади, лабораторний посуд і матеріали (на 1 підгрупу студентів): фотоелектрокалориметр ФЕК-И – 1; рН-метр – 1; центрифуга лабораторна; віскозиметри Освальда (капіляри 0,6 – 0,8мм) – 3; ареометри –3; секундоміри – 3; ферментатори (місткістю 1,5 л) – 3; фільтрувальний папір; водяна баня – 4; 0,1 н розчин NaOH – 100 см3, індикатор фенолфлалеїн, градуювальні піпетки місткістю 10 см3 – 4; градуювальні піпетки місткістю 20 см3 – 4; мірні колби місткістю 250 см3 – 8; конічні колби місткістю 100 см3;циліндри на 100 см3 – 3; піпетки об’ємом 1 мл – 6; склянки хімічні, місткістю 500 см3 – 6; пробірки – 20; пектолітичний ферментний препарат – 3 г; амілолітичний ферментний препарат – 3 г; танін сухий – 1 г; повітряно-сухий бентоніт 20 г; спирт етиловий – 30 см3; розчин йоду 0,01н – 10 г; желатин сухий – 1 г;
сировина: сік плодовий неосвітлений – 3 л;
Date: 2015-10-19; view: 595; Нарушение авторских прав