
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Классификация белков
|
|
В настоящее время все белки разделяют на две большие группы: простые белки, или протеины, построенные только из остатков аминокислот, и сложные белки, или протеиды, состоящие из простого белка и связанного с ним какого-либо соединения небелковой природы.
Протеины делят на группы в зависимости от их растворимости в различных растворителях.
Рассмотрим следующие протеины, относящиеся к широко распространенным глобулярным белкам: альбумины, глобулины, гистоны, протамины, проламины, глутелины, а также фибриллярные белки: фибриноген, миозин и актин.
Альбумины хорошо растворяются в воде, но не растворяются в насыщенном растворе сульфата аммония. Широко распространены в животном и растительном мире. Имеют относительно небольшую молекулярную массу. Альбумины характеризуются повышенным содержанием лейцина и очень малым количеством глицина. Изоэлектри-ческая точка этих белков лежит при рН ≈ 5. Они являются составными частями крови, мышц, молока, цитоплазмы почти всех клеток. Типичными представителями альбуминов являются овальбумин куриного яйца, лактальбумин молока, сероальбумин сыворотки крови.
Глобулины нерастворимы в воде и слабых кислотах, выпадают в осадок при 50 %-й концентрации сульфата аммония. Хорошо растворимы в слабых растворах нейтральных солей. Глобулины в отличие от альбуминов содержат большее количество глицина. Они также широко распространены в организме животных и растений. У высших организмов глобулины выполняют роль защитных белков, из них обра- зуются антитела. В крови человека содержится несколько типов глобулинов — а-, {$-, у-. Некоторые из них осуществляют перенос ионов металлов в плазме: трансферрин транспортирует железо, церулоплазмин — медь.
Гистоны — низкомолекулярные белки, растворимые в воде и кислых растворах, при добавлении аммиака легко выпадают в осадок. Обладают щелочным характером благодаря высокому содержанию основных аминокислот — аргинина и лизина (25—30 %). Гистоны локализованы в ядре и играют важную биологическую роль в организме. Соединяясь с нуклеиновыми кислотами, они обусловливают их уникальную структуру, необходимую для биосинтеза белков. Изо-электрическая точка гистонов составляет около 10.
Протамины по своей растворимости сходны с гистонами. Также низкомолекулярные белки с более выраженным основным характером. Протамины содержат больше аргинина и лизина, чем гистоны,— до 50—80 %, причем 90 % всего азота в протаминах принадлежит аргинину. Значительное количество протаминов находится в сперме рыб, печени, селезенке, почках и железах внутренней секреции. Биологическая роль протаминов такая же, как и гистинов.
Проламины — растительные белки. Плохо растворяются в воде, хорошо — в 60—80 %-м этиловом спирте. Эти белки содержат до 10—15 % пролина и 20—50 % глутаминовой кислоты. Проламины — ценные продукты питания. Это глиадин пшеницы и ржи, гордеин ячменя, аверин овса и др.
Глутелины — также растительные белки. Растворяются в разбавленных растворах щелочей и кислот. Содержат в значительных количествах глутаминовую кислоту и лизин. Глутелины являются ценными пищевыми белками.
Фибриноген —фибриллярный белок, растворим в концентрированных солевых растворах и нерастворим в воде. Является составной частью плазмы крови и выполняет защитную функцию (плазмой крови называют ее жидкую часть, освобожденную от взвешенных в ней телец; жидкость, отделяющуюся при коагуляции, называют сывороткой. Таким образом, в сыворотке в отличие от плазмы фибриноген не содержится). В результате сложных химических реакций фибриноген превращается в фибрин, который образует густую сеть разветвленных нитей. В этих нитях оседают эритроциты крови, в результате чего образуется сгусток (тромб), который препятствует потере крови организмом.
Актин и миозин — водонерастворимые фибриллярные белки, из которых состоят миофибриллы — сократительные элементы клеток мышечной ткани.
Молекулы миозина представляют собой толстые длинные нити с глобулярной головкой, состоящие из двух идентичных полипептидных цепей. Эти цепи необычны тем, что являются наиболее длинными из известных в настоящее время. Каждая цепь молекулы миозина закручена в виде а-спирали, причем обе цепи образуют суперспираль, т.е. закручены относительно друг друга, образуя двуспиральную структуру. На одном конце молекулы миозина обе цепи образуют глобулярную структуру (рис. 32). Миозин (его глобулярная часть) обладает очень важной особенностью — он расщепляет богатое энергией вещество — аденозинтрифосфорную кислоту (АТФ), высвобождая тем самым энергию, необходимую для мышечного сокращения.
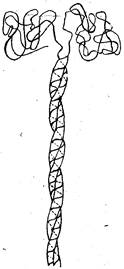 Рис. 32. Строение молекулы миозина.
Рис. 32. Строение молекулы миозина.
Другой составной частью миофибрилл является белок под названием актин. Существует две формы этого белка: неактивный, или глобулярный, актин (G-актин) и активный, или фибриллярный (F-актин). Эти две формы могут превращаться друг в друга. Следует подчеркнуть, что превращение глобулярной формы в фибриллярную происходит не путем растягивания глобулы, а в результате объединения отдельных глобул в отдельную цепь. Другими словами, фибриллярный актин является продуктом полимеризации G-актина. Отдельные цепи, образованные такими маленькими сферами, образуют двойную спираль, или суперспираль (рис. 33). В целом же молекулы F-актина представляют собой тонкие небольшие нити. Особенностью G-актина является способность очень прочно связывать один ион Са2+ и одну молекулу АТФ или АДФ. При этом связывание АТФ G-актином обычно сопровождается его ассоциацией с образованием -F-актина.
 Рис. 33. Строение двойной спирали F-актина.
Рис. 33. Строение двойной спирали F-актина.
Актин и миозин, соединяясь вместе, образуют актомиозиновый комплекс, который является основным сократительным белком мышечной ткани. Механизм мышечного сокращения выглядит следующим образом. Глобулярная головка миозина присоединяет АТФ и взаимодействует с тонкой нитью актина. Миозин расщепляет АТФ, это приводит к изгибанию головки миозина, в результате чего тонкая нить актина, перемещается, проскальзывая между толстыми волокнами. Затем миозин отделяется от актина, присоединяет новую молекулу АТФ, и процесс повторяется. Таким образом, мышечное сокращение является результатом скольжения тонких нитей актина вдоль толстых волокон миозина. В этом процессе принимают участие ионы Са2+ (рис. 34).
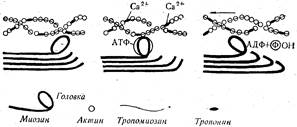 Рис. 34. Схема мышечного сокращения.
Рис. 34. Схема мышечного сокращения.
Известна еще одна группа белков — протеиноиды, или склеропротеиды. Эти белки очень прочны и эластичны, не растворяются в воде, растворах кислот, щелочей, солей, не расщепляются ферментами. Входят в состав опорной и покровной тканей (костей, хрящей, сухожилий, волос, кожи) и относятся к фибриллярным белкам.
В организме больше всего содержится коллагена, который является основным белковым компонентом кожи, сухожилий, хрящей. Очень интересны физические свойства коллагена. По своей прочности он может сравниться с прочностью стальной проволоки. В составе этого белка содержится повышенное количество глицина (30 % суммы аминокислот), а также оксипролин и оксилизин.
Молекула коллагена состоит из трех полипептидных цепей, связанных между собой водородными связями и образующих тройную спираль. При длительном кипячении коллаген превращается в желатин.
В крупных артериях содержится другой белок — эластин, также богатый глицином и пролином. Особенностью этого белка является способность к растяжению.
В качестве основного белкового компонента волос, ногтей и шерсти является кератин, шелка — фиброин.
Протеиды. К группе сложных белков, или протеидов, как указывалось выше, относятся такие, в состав которых кроме белковой части входит какая-либо небелковая, так называемая простетическая, группа, прочно связанная с белком. Все протеиды делят на группы в зависимости от природы их небелковой части.
Хромопротеиды — сложные белки, молекулы которых состоят из простого белка и окрашенной простетической группы, откуда и получили свое название (от греч. Урюца — краска). Белковая часть чаще всего представлена гистонами, а простетические группы—различными окрашенными соединениями: витамином В2, каротином, порфирином. Многие хромопротеиды в составе небелковой группы содержат металлы, поэтому их еще называют мет-таллопротеидами.
В организме человека и высших животных одним из наиболее важных хромопротеидов является гемоглобин — красный железосодержащий белок, обладающий способностью переносить газы с током крови. При изучении четвертичной структуры белка в качестве примера были рассмотрены структура и порядок размещения полипептидных цепей в молекуле гемоглобина. Теперь более подробно остановимся на строении его небелковой части, называемой гемом.
Молекулу гема составляют четыре производных пиррола, которые соединены между собой метановыми группами (—СН=), четыре ме-тильных радикала (—СН3), два винильных радикала (—СН=СН2), два остатка пропионовой кислоты (—СН2СН2СООН) и один атом двухвалентного железа. Строение его выражается следующей формулой;
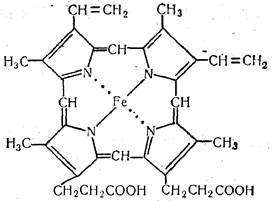
Биологическая особенность гема заключается в том, что он способен соединяться с газами (кислородом, оксидом углерода СО и др.). Эту способность гем проявляет и в составе молекулы гемоглобина— соединения гема с белком глобином. В легких к гемоглобину присоединяется кислород и разносится кровью ко всем органам и тканям. При этом окисления железа не происходит и оно остается двухвалентным. Такая связь между кислородом и гемом является непрочной, и в тканях кислород легко отщепляется, гемоглобин присоединяет углекислый газ и транспортирует его к легким. Здесь углекислый газ отщепляется и выводится из организма при дыхании. Освободившийся гемоглобин снова присоединяет кислород, и процесс повторяется.
Более прочное соединение образует гемоглобин с оксидом углерода (II), или угарным газом — СО, в связи с чем теряет способность присоединять кислород. Вследствие этого кислорода к органам и тканям поступает меньше, возникает кислородное голодание, которое приводит к потере сознания, а иногда и к смерти.
Фосфопротеиды — сложные белки, в молекулах которых белок связан с фосфорной кислотой. Наиболее изученным фосфопро-теидом является казеин — белок молока. Он является ценным питательным веществом для человека и животных. Казеин — источник фосфора для образования макроэргических соединений, фосфатидов, многих белков, для построения костей. К фосфопротеклам относятся пепсин — основной фермент желудочного сока, расщепляющий белки до пептидов, овальбумин — белок куриного яйца и белки желтка вителлин, вителленин, фосфовитин.
Липопротеиды — сложные белки, в молекулах которых белок связан с липидами. Они являются основой биологических мембран, миелиновых оболочек нервных волокон. В свободном виде содержатся в лимфе, крови, молоке, яичном желтке. Биологическая роль липопротеидов состоит в том, что они обеспечивают транспортирование жиров в тканях и клетках. В форме липопротеидных комплексов транспортируются в клетки витамины A, D, Е, К и F.
Гликопротеиды — сложные белки, в состав которых входят углеводы и их производные (манноза, галактоза, глюкуроновая, гиалуроновая и хондроитинсерная кислоты, гепарин). Они играют очень важную роль во многих физиологических процессах организма человека и животных. Так, гепарин является антикоагулянтом крови. Гликопротеиды, содержащие хондроитинсерную и гиалуроновую кислоты, входят в состав хрящевой и соединительной тканей, связок и сухожилий. Эти гликопротеиды называют еще мукопротеидами, или мукоидами.
К группе гликопротеидов относятся также муцины — слизистые выделения пищевого канала (слюна, желудочные и кишечные слизи) Они выполняют защитную функцию, предохраняя стенки органов пищевого канала от механических и химических повреждений. В слюне собаки содержится специальный муцин — лизоцим, который является сильным бактериостатическим фактором. Таким образом, зализывая раны, собаки предохраняют их от бактериального заражения.
Нуклеопротеиды — одна из самых важных групп белков. Они представляют собой соединения белков с нуклеиновыми кислотами. Белковая часть нуклеопротеидов чаще всего представлена прот-аминами и гистонами. Нуклеиновые кислоты как составная часть нуклеопротеидов и как индивидуальные вещества выполняют исключительно важную роль в организме. Их строению и функциям будет посвящен следующий раздел.
Date: 2015-09-22; view: 1021; Нарушение авторских прав