
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Современные представления о строении белков
|
|
Изучая белки и продукты их гидролиза, А. Я. Данилевский (1888 г.) обнаружил, что щелочные растворы белков при добавлении раствора сульфата меди окрашиваются в фиолетовый цвет. Такую же окраску дает и соединение, образующееся из двух молекул мочевины при отщеплении молекулы аммиака,— биурет, откуда и сама реакция получила название биуретовой:
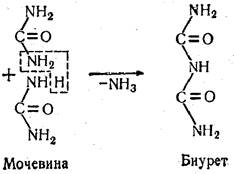
На основании этих данных А. Я. Данилевский сделал предположение, что в основе строения белков лежит биуретовая структура 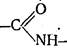 . Продукты полного гидролиза белков не давали биуретовой реакции, что свидетельствовало о разрушении их биуретовой структуры. Следовательно, можно предположить, что отдельные аминокислоты соединяются между собой посредством связи —СО—NH—, которую позже стали называть пептидной. Она образуется в результате взаимодействия карбоксильной группы одной аминокислоты и аминной группы другой.
. Продукты полного гидролиза белков не давали биуретовой реакции, что свидетельствовало о разрушении их биуретовой структуры. Следовательно, можно предположить, что отдельные аминокислоты соединяются между собой посредством связи —СО—NH—, которую позже стали называть пептидной. Она образуется в результате взаимодействия карбоксильной группы одной аминокислоты и аминной группы другой.
Это предположение было подтверждено экспериментально Э. Фишером и его учениками. Синтезировав свыше 200 пептидов, в том числе полипептид, состоящий из 19 аминокислот, они доказали, что в белках действительно существует связь, подобная биуретовой.
В начале XX в. Э. Фишер создал полипептидную теорию строения белка, согласно которой остатки аминокислот в молекуле белка соединяются между собой пептидными связями, образуя длинные полипептидные цепи. Наряду с этим была установлена полипептидная природа таких гормонов, как вазопрессин и окситоцин.
Для полипептидов были введены полное и сокращенное названия. При полном наименовании пептидов в названии аминокислоты, участвующей в образовании пептидной связи своей карбоксильной группой, окончание -ан изменяется на -ил. Окончание аминокислоты, карбоксильная группа которой остается свободной, не изменяется. Например, гексапептид, состоящий из остатков глицина, аланина, треонина, валина, метионина и серина, имеет название глицилаланилтреонилвалилметионилсерин;
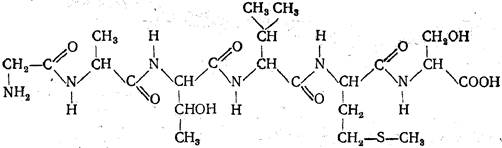
При сокращенном наименовании каждый аминокислотный остаток называется первыми тремя буквами его полного названия. Приведенный выше гексапептид обозначается следующим образом; Гли — Ала — Тре — Вал — Мет — Сер. Так же обозначаются и свободные аминокислоты; амиды аспарагиновой и глутаминовой кислот — соответственно Асн и Глн, изолейцин — Иле, цистеин — 1/2 Цис.
Таким образом, основной химической связью в белковой молекуле является пептидная, или кислотоамидная, связь между остатками аминокислот. Эта связь прочная и относится к ковалентному типу.
Другим видом ковалентной связи являются дисульфидные связи, образующиеся в результате окисления SH-групп остатков цистеина:
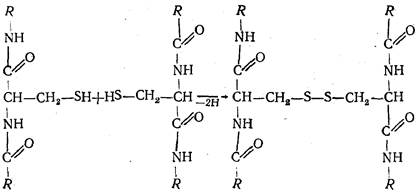
Дисульфидные связи могут возникать между отдельными полипептидными цепями в местах, где два остатка цистеина расположены друг против друга, а также между остатками этих аминокислот в одной цепи, когда полипептидная цепь образует определенные изгибы и спирали. Во втором случае дисульфидные связи удерживают специфическую конфигурацию полипептидной цепи в пространстве, которая образовалась при определенных условиях существования белка. Устойчивость многих белков в значительной степени обусловлена количеством и прочностью этих связей, которые как бы «прошивают» молекулы отдельных белков, придавая им прочность, нерастворимость и т.д. Примерами таких белков являются коллаген кожи, белки волос, шерсти, рогов, эластин и т.д.
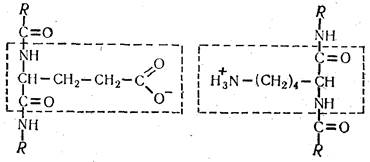
Кроме пептидной и дисульфидной в молекуле белка существует ионная, или солевая, связь, которая возникает между разноименно заряженными группами аминокислотных остатков аспарагиновой и глутаминовой кислот, аргинина, лизина и гистидина. Концевые и свободные СООН- и NН2-группы могут находиться в ионизированном состоянии. В результате электростатического притяжения образуется ионная связь, которая может объединять витки как одной, так и разных полипептидных цепей:
Наряду с упомянутыми выше в молекуле белка существует водородная связь, образующаяся между частично электроотрицательными атомами кислорода карбонила 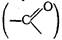 одной пептидной связи и частично электроположительным атомом водорода иминной группы (Н—N<) — другой. Водородная связь, так же как и дисульфидная, соединяет полипептидные цепи или их отдельные участки:
одной пептидной связи и частично электроположительным атомом водорода иминной группы (Н—N<) — другой. Водородная связь, так же как и дисульфидная, соединяет полипептидные цепи или их отдельные участки:
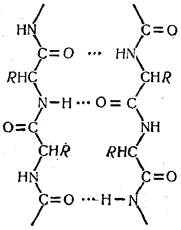
Водородная связь намного слабее, чем пептидная, дисульфидная и ионная. Но поскольку в образовании этой связи принимают участие все пептидные связи, белковая система оказывается в максимальной степени насыщенной водородными связями. Поэтому они приобретают очень большое значение в стабилизации белковой молекулы.
Рассмотренные химические связи имеют ярко выраженный полярный характер. Однако в белках существуют углеводородные радикалы таких аминокислот, как аланин, валин, лейцин, изолейцин, фенилала-нин, триптофан, которые не несут электрического заряда и не растворяются в воде. Радикалы этих кислот называют гидрофобными группами (—СН3, —С2Н5 и т.д.) Между такими группами также могут возникать силы взаимного притяжения, в результате чего образуется слабая гидрофобная связь:
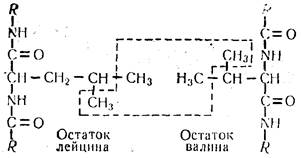
В результате того, что молекулы воды выталкивают гидрофобные радикалы указанных аминокислот из белковой молекулы, образуется система, напоминающая коллоидную частицу, внутри которой размещена гидрофобная, снаружи — гидрофильная части молекулы белка. Сближение этих радикалов обусловлено характером взаимодействия гидрофобных групп с водой, молекулы которой образуют структуру, напоминающую кристаллы льда.
Необходимо отметить, что слабые химические связи (электростатическое взаимодействие между свободными и концевыми NH2- и СООН-группами, водородные связи, а также гидрофобное взаимодействие) играют важную роль в поддержании и стабилизации строго определенной конфигурации белковой молекулы в пространстве.
Date: 2015-09-22; view: 3135; Нарушение авторских прав