
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уровни организации молекул белка
|
|
В нативном, состоянии (состоянии, при котором белки выполняют свои биологические функции) молекула белка обладает характерной для нее пространственной структурой (конформацией).
В зависимости от конформации, т.е. характера расположения полипептидной цепи в пространстве, или, другими словами, от формы молекул, белки можно разделить на две большие группы —фибриллярные и глобулярные. Полипептидные цепи фибриллярных белков располагаются параллельно друг другу вдоль одной оси, образуя длинные нитеподобные волокна — фибриллы. Они являются основными структурными элементами соединительной и костной тканей, коллагена сухожилий, роговых образований, кожи, ногтей, перьев, волос. Это устойчивые вещества, нерастворимые в воде и разбавленных солевых растворах.
Глобулярные белки характеризуются сферической, или глобулярной структурой, полипептидные цепи которых свернуты в компактные образования, напоминающие форму шара (глобулы). Таких белков в организме значительно больше, чем фибриллярных. К ним относятся почти все известные в настоящее время ферменты, а также антитела, некоторые гормоны и белки, выполняющие транспортную функцию (гемоглобин, сывороточный альбумин и т.д.). Большинство глобулярных белков растворимы в воде и легко диффундируют.
Некоторые белки занимают промежуточное положение. Как и фибриллярные, они состоят из нитеподобных структур, в то же время, подобно глобулярным белкам, растворимы в водных солевых растворах.
Для обозначения различных уровней структуры молекулы белка пользуются понятиями первичной, вторичной, третичной и четвертичной структур.
Первичная структура характеризует качественный аминокислотный состав полипептидной цепи, количество аминокислотных остатков в ней, связанных пептидными связями, и порядок чередования этих остатков. Данная структура дает представление о размещении молекулы белка в плоскости.
Однако знания первичной структуры белка недостаточно для представления о его полном строении. В действительности молекула белка не лежит в одной плоскости.
Вторичная структура — форма белковой цепи, способ размещения ее в пространстве — в значительной степени определяется условиями среды, в которой находится белок, а также особыми свойствами и строением пептидной связи.
Изучая фибриллярные белки, Л. Полинг и Р. Кори установили основные параметры пептидной связи, откуда следовало, что расстояние между атомами углерода и азота (т.е. длина пептидной связи) составляет 0,132 нм. Это значение является средним между значениями длины обычной одинарной C-C (0,154 нм) и двойной >C = О (0,123 нм) связей. Следовательно, пептидная связь близка по своему характеру к двойной и свободное вращение по ней невозможно. Четыре атома пептидной связи (О, С, N, Н) и два α-углеродных атома расположены в одной плоскости, а атомы кислорода и водорода — в транс-положении по отношению к пептидной связи. Кроме того, были измерены также углы между отдельными атомами (рис. 25).
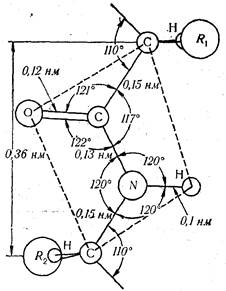 Рис. 25. Основные параметры пептидной связи.
Рис. 25. Основные параметры пептидной связи.
Используя полученные данные о структуре пептидной связи, Л. Полинг и Р. Кори построили модели коротких пептидов и пришли к выводу, что полипептидная цепь представляет собой длинный ряд плоскостей, разделенных между собой α-углеродными атомами, или метиленовыми мостиками. В связи с этим первичную структуру белковой молекулы более точно можно представить как длинную цепь, состоящую из большого числа плоскостей пептидных связей, к которым под определенными углами присоединяются радикалы соответствующих аминокислот.
Установив возможные места вращений, Полинг и Кори пришли к другому важному выводу — простейшей пространственной структурой пептидной цепи является спираль. В структуре, названной α-спиралью и характерной для α -кератинов, периодически повторяющейся единицей является виток (рис. 26). Он занимает вдоль оси около 0,54 нм и называется большим периодом спирали. На один виток приходится 3,6 аминокислотных остатка. Один такой остаток занимает 0,15 нм и представляет собой малый период α-спирали. Такая α-спиральная структура пептидной цепи допускает образование внутрицепочечных водородных связей между витками спирали. Установлено, что они образуются между атомами водорода, связанными с электроотрицательным атомом азота одной пептидной связи, и атомом кислорода карбонильной группы четвертого по счету остатка. При этом каждая пептидная связь цепи принимает участие в образовании водородных связей (первая с четвертой, вторая с пятой, третья с шестой и т.д.), так что вся система в максимальной степени насыщена этими связями.
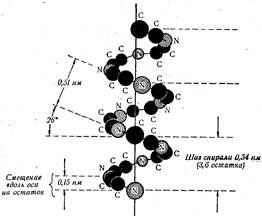 Рис. 26. Средние размеры α-спирали. Шаг спирали и смещение в расчете на один аминокислотный остаток соответствуют большому (0,54 нм) и малому (0,15 нм) периодам.
Рис. 26. Средние размеры α-спирали. Шаг спирали и смещение в расчете на один аминокислотный остаток соответствуют большому (0,54 нм) и малому (0,15 нм) периодам.
Возможны также и другие способы спиральной упаковки пептидных цепей, однако α-спиральная конфигурация наиболее стабильна. Предполагается, что такую форму пептидные цепи принимают произвольно, поскольку она обладает наименьшей свободной энергией.
В настоящее время твердо установлено, что фибриллярные белки, относящиеся к α -кератинам (волосы, шерсть, роговые образования, ногти, кожа, перья и т.д.), состоят из параллельно расположенных пептидных цепей, имеющих α -спиральную конфигурацию. Необходимо подчеркнуть, что стремление к образованию устойчивой α -спирали определяется природой и последовательностью аминокислотных остатков в цепи и зависит от рН среды.
Хорошо изучена и другая форма размещения пептидной цепи в пространстве. Она получила название β-конформации и имеет вытянутую зигзагообразную форму (рис. 27). Параллельные цепи, находящиеся в β-конформации, связываются между собой поперечными межцепочечными водородными связями и образуют слоисто-складчатую структуру. В поперечном связывании, так же как и в α -спирали, принимают участие все пептидные связи, что придает данной структуре высокую стабильность. Структура типа складчатого слоя напоминает по форме растянутую α-спираль и характерна для белков β-кератинов. Примером такого белка может быть фиброин, из которого состоят нити шелка.
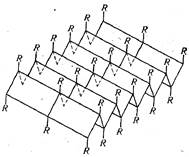 Рис. 27. β-Конформация полипептидной цепи.
Рис. 27. β-Конформация полипептидной цепи.
Таким образом, вторичная структура белковой молекулы — это такая конфигурация пептидной цепи в пространстве, которая представляет собой форму спирали или слоисто-складчатую структуру. Вторичная структура является высшей формой организации для фибриллярных белков.
Спиралевидную, или вторичную, структуру белка можно по-разному разместить в определенном объеме. Способ укладки вторичной структуры с образованием клубков различной формы называют третичной структурой. Этот еще более высокий уровень организации молекул белка характерен для глобулярных белков. Третичная структура довольно сложна, и ее изучение представляет определенные трудности. Поэтому в настоящее время эта структура хорошо изучена для небольшого количества белков.
Существенную роль в образовании третичной структуры играют водородные и дисульфидные связи, способствующие ее созданию, а также наличие локальных неустойчивых точек, в которых α-спираль может изгибаться. Как правило, в местах изгибов пептидной цепи находятся остатки пролина, а также аминокислоты, которые не способны легко образовывать α-спиральные структуры, например изолейцин или серии, а аминокислоты, боковые цепи которых при рН = 7 имеют одинаковые заряды. Радикалы таких кислот, отталкиваясь друг от друга, нарушают спирализацию цепи, отчего в этих местах пептидная цепь легко изгибается. Считают, что третичная структура возникает автоматически в результате взаимодействия аминокислотных остатков с молекулами растворителя. При этом гидрофобные радикалы «втягиваются» внутрь белковой молекулы, а гидрофильные группы ориентируются в сторону растворителя. Таким образом формируется компактная молекула белка, внутри которой практически отсутствуют молекулы воды. Это приводит к созданию энергетически выгодной конформации молекулы белка.
Белком с хорошо изученной трехмерной структурой является миоглобин. Исследования, проведенные Дж. Кендрю с сотрудниками показали, что молекула миоглобина состоит из одной пептидной цепи, закрученной в спираль. В местах изгибов, где спирализация отсутствует, находится пролин. Пептидная цепь миоглобина напоминает длинную, причудливой формы «колбасу» (рис. 28). Такая специфическая структура, возникающая в результате скручивания и изгибания, и называется третичной структурой миоглобина.
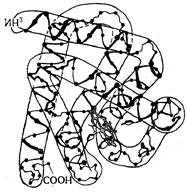 Рис. 28. Третичная структура миоглобина.
Рис. 28. Третичная структура миоглобина.
Еще более высоким уровнем организации белковой молекулы является четвертичная структура. Она возникает в результате ассоциации нескольких пептидных цепей, имеющих первичную, вторичную и третичную структуры. Другими словами, данный уровень организации представляет собой объединение нескольких пептидных цепей с третичной структурой в одну большую молекулу (рис. 29), молекулярная масса которой уже превышает 50000. Такие белки называются олигомерами. Каждая пептидная цепь, входящая в состав олигомерного белка, носит название протомера, которые объединяясь, образуют субъединицы. Этим термином обозначают функционально активную часть олигомерного белка. Таким образом, четвертичная структура характерна для олигомерных белков.
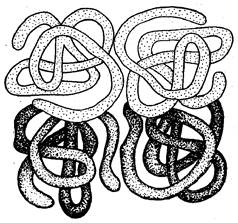 Рис. 29. Схема четвертичной структуры белка. Четыре протомера объединены в две пары субъединиц, образуя сложную белковую молекулу.
Рис. 29. Схема четвертичной структуры белка. Четыре протомера объединены в две пары субъединиц, образуя сложную белковую молекулу.
Классическим примером олигомера, или белка с четвертичной структурой, является гемоглобин. Белковая часть его молекулы, называемая глобином, состоит из четырех протомеров — двух идентичных α-цепей и двух идентичных β-цепей; α - и β- цепи, объединяясь попарно, образуют две пары субъединиц, на которые может диссоциировать молекула гемоглобина (рис. 30).
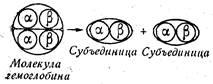 Рис. 30. Схема диссоциации молекулы гемоглобина на две субъединицы.
Рис. 30. Схема диссоциации молекулы гемоглобина на две субъединицы.
Таким образом, молекула гемоглобина состоит из четырех пептидных цепей, которые плотно упакованы вместе и образуют единую глобулярную структуру. Между отдельными цепями нет прочных ковалентных связей, тем не менее вся молекула обладает высокой стабильностью.
Установлено, что по своей третичной структуре α - и β-цепи очень сходны с третичной конфигурацией единственной цепи миоглобина. Это свидетельствует о том, что сходная биологическая функция этих двух белков, заключающаяся в их способности обратимо связывать кислород, объясняется сходством третичной структуры их пептидных цепей. В заключение необходимо еще раз подчеркнуть, что вторичная, третичная и четвертичная структуры белковых молекул определяются аминокислотной последовательностью пептидной цепи, т.е. первичной структурой. Кроме того, конфигурация пептидной цепи определяется также размером, формой и последовательностью расположения R-групп аминокислот.
Для каждого белка характерна по крайней мере одна трехмерная структура, в которой он стабилен и проявляет биологическую активность при физиологических условиях (температура, рН). Эта структура носит название нативной конформации белка.
Date: 2015-09-22; view: 1423; Нарушение авторских прав