
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Осаждение белков
|
|
Устойчивость белкового раствора в значительной степени обусловлена наличием положительного или отрицательного заряда на белковой молекуле, вследствие чего молекулы отталкиваются друг от друга и находятся во взвешенном состоянии.
Другой важной причиной устойчивости белковых растворов являются гидрофильные свойства белка, обусловленные наличием карбоксильных, аминных и гидроксильных групп. Полярные молекулы воды, присоединяясь к диссоциирующим функциональным группам, образуют вокруг белковых частичек гидратную оболочку, которая препятствует их слипанию.
Отсутствие заряда и гидратной оболочки способствует сближению белковых молекул, в результате чего они слипаются друг с другом, увеличиваются в размерах и выпадают в осадок под действием собственной силы тяжести. Это явление носит название коагуляции.
Коагуляция может быть обратимой, если после прекращения действия какого-либо фактора, вызывающего коагуляцию, белок возвращается к своему первоначальному состоянию. Если же скоагулировавший белок не может вернуться к исходному состоянию, то говорят о необратимой коагуляции.
Примером обратимой коагуляции может быть осаждение белков растворами нейтральных солей (NaCl, (NH4)2SO4,Na2SO4) различной концентрации, которое называется высаливанием. Указанные электролиты нейтрализуют электрический заряд белка и разрушают его гид-ратную оболочку, в результате чего белок становится неустойчивым и выпадает в осадок. При добавлении к такому осадку воды белок снова переходит в растворенное состояние. Процесс, обратный коагуляции, называется пептизацией.
Необратимую коагуляцию вызывает высокая температура. При нагревании белок свертывается и выпадает в осадок. Такое же действие оказывают и соли тяжелых металлов (Сu, Hg, Ag, Pb и др.). Они, взаимодействуя с белками, образуют нерастворимые в воде комплексные соединения.
Концентрированные неорганические кислоты—соляная, азотная, серная — и такие органические вещества, как сульфосалициловая, трихлоруксусная и пикриновая кислоты, фенол, формалин, ацетон, также обладают способностью вызывать необратимую коагуляцию белков.
Перечисленные факторы (температура, осаждение солями тяжелых металлов, минеральными кислотами и органическими веществами) вызывают глубокие внутренние изменения в структуре белка. Нарушается его специфическая конфигурация, в результате чего характерным образом свернутая полипептидная цепь разворачивается и образует случайные, хаотические, беспорядочные петли или клубки. При этом белок теряет биологическую активность. Такие внутренние изменения в строении белка, связанные с потерей его биологической активности, называются денатурацией (рис. 31). В более широком смысле под денатурацией понимают утрату белком его уникальной конфигурации, т.е. вторичной, третичной и четвертичной структур. Остается лишь первичная структура, которая удерживается прочной ковалентной пептидной связью. Характерным признаком денатурации белка является снижение его гидрофильности и растворимости, в результате чего он выпадает в осадок, т. е. необратимо осаждается из раствора. в связи с этим денатурацию можно рассматривать как необратимую коагуляцию.
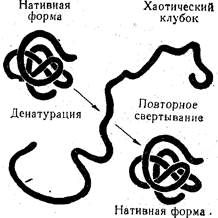 Рис. 31. Денатурация глобулярого ного белка.
Рис. 31. Денатурация глобулярого ного белка.
Белки обладают также и другими характерными свойствами. Растворяясь в воде, они образуют коллоидные растворы, которые обладают низким осмотическим давлением. Коллоидные растворы белков обычно непрозрачны, способны рассеивать лучи света (эффект Тиндаля) и опалесцировать — в проходящем свете они принимают красноватую окраску, в отраженном — синюю. В связи с большими размерами молекул белки почти не проникают через клеточную мембрану, а также через поры коллодия и целлофана, на чем основано отделение их от низкомолекулярных соединений, например солей. Белки обладают большой степенью набухания и связывают около 80—90 % всей воды в организме.
Для белков характерен ряд цветных реакций, которыми обычно пользуются для их обнаружения и количественного определения.
Date: 2015-09-22; view: 2236; Нарушение авторских прав