
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 8. ПЕРЕСАДКА ПЕЧЕНИ
|
|
Первая пересадка печени у человека выполнена в 1963 г. Она закончилась смертью больного. Неудачным были и 7 последующих пересадок, произведенных в 1963—1968 гг. в Колорадо, Париже и Бостоне. Только спустя 5 лет после первой пересадки Т. Е. Starzl сообщил об успешной операции.
В 1983 г. Национальным институтом здоровья (США) ортото-пическая пересадка печени была признана методом выбора при лечении целого ряда заболеваний печени в терминальной стадии.
К началу 1990 г. в мире действовали более сотни центров трансплантации печени, в которых выполнено более 10 000 операций. Показатель годичной выживаемости больных достигает 80 °/о и более.
В силу целого ряда причин в СССР вплоть до конца 1990 г. пересадка печени не производилась. И только в 1991 г. в печати были опубликованы результаты 5 пересадок печени в НИИ трансплантологии и искусственных органов (В. И. Шумаков и соавт., 1991).
Показания к пересадке печени значительно изменились с накоплением опыта отдаленных результатов.
У лиц старше 40 лет выживаемость более 1 года отмечена только в 10 % наблюдений, в связи с чем считают непоказанной трансплантацию пациентам в возрасте 45 лет и старше (Ch. W. Putman и соавт., 1977).
Временное подключение гомо- и гетеропечени может быть использовано как метод поддержания функции организма. При этом используют как трупную печень человека, так и печень животных, в первую очередь свиную (Б. В. Петровский и соавт., 1972). Забор печени у животных проводят под наркозом с интубацией трахеи и искусственной вентиляцией легких с повышенной оксигена-цией вдыхаемого воздуха. Для введения в наркоз используют гексенал по 18—20 мл 5 % раствора на 1 кг массы тела. В процессе взятия органа животное получает внутривенно 4 % раствор натрия гидрокарбоната (200—400 мл), 5 % раствор глюкозы (300— 400 мл), изотонический раствор натрия хлорида (200—300 мл). Производят широкую лапаротомию и стернотомию. Печень перфу-зируют через воротную вену раствором Рингера при температуре
4 °С. После введения первых 200—300 мл перфузата пережимают нижнюю полую вену в надпеченочном сегменте, а в подпеченочный сегмент ее вставляют катетер для оттока перфузата. Перфузию проводят под давлением 40—60 см вод. ст., используя 18—20 л раствора. Затем печень извлекают и помещают в специальный контейнер.
Известны два метода подключения изолированной печени к больному: 1) артерия реципиента — воротная вена изолированной печени — нижняя полая вена изолированной печени — вена реципиента (рис.35);
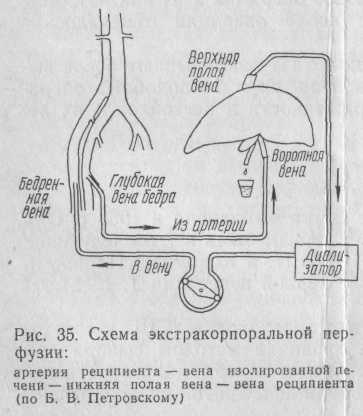
2) вена реципиента — воротная вена изолированной печени — нижняя полая вена изолированной печени — вена реципиента — рис. 36 (Б. А. Петров, 1970).
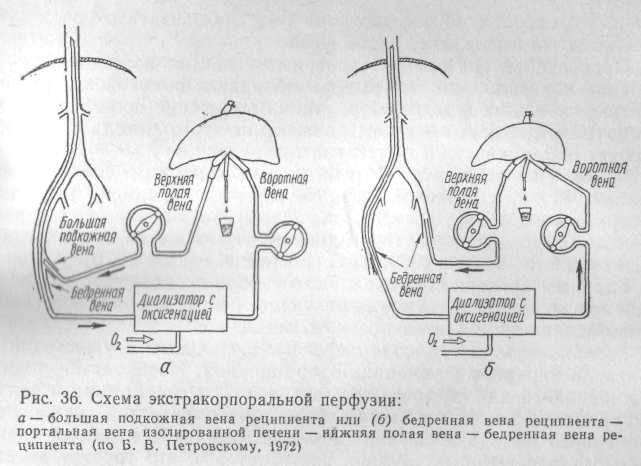
Для перфузии по второму методу необходима дополнительная оксигенация крови, поступающей в подключенную печень.
Перфузию проводят со скоростью 0,5—2 мл крови на 1 кг массы печени в 1 мин при давлении 180—200 мм вод. ст. в течение 2,5—3 ч (Б. А. Петров, 1970; Г. М. Соловьев и соавт., 1972).
Временное подключение гетерологической печени используется как метод лечения острого некротического гепатита с прогрессирующими явлениями печеночной недостаточности.
В последние годы начато изучение эффективности пересадки взвеси гепатоцитов как метода лечения острой печеночной недоста точности. Методика приготовления взвеси заключается в следующем (L. H. Toledo-Pereyr и соавт., 1982). Донорскую печень резецируют, помещают в ледяной солевой раствор и промывают гепаринизированным раствором Рингера-лактата при температуре 4 °С. Из отмытой печени берут около 2 см3 ткани и добавляют раствор Рингера-лактата из расчета 3 мл на 1 г ткани. Ткань печени измельчают механическим методом в течение 60—75 с, а затем повторно дважды промывают на холодовой центрифуге. К полученной взвеси добавляют коллагеназу из расчета 500 ед на 1 г ткани и смешивают на водяной бане при температуре 37°С в течение 5—10 мин. После этого добавляют холодную среду при температуре 4°С и четырехкратно промывают взвесь. Полученную ткань помещают в 50 мл раствора Рингера-лактата и используют для введения в селезенку реципиента.
Проведенные авторами экспериментальные исследования на собаках показали, что гепатоциты обладают высокой иммуногенностью, гибель их вследствие реакции отторжения происходит в течение 1—6 сут, в связи с чем применение этого метода в клинике требует осторожности и тщательного изучения.
Забор трансплантата. Оптимальными донорами считают лиц моложе 45 лет с тяжелой черепно-мозговой травмой, разрывом аневризмы мозговых сосудов, первичной опухолью мозга, врожденными пороками развития головного мозга, не совместимыми с жизнью (Т. Е. Starzl, 1969; Т. G. Fortner и соавт., 1970).
Главным критерием возможности забора органов считают понятие «мозговой смерти», характеризующее невозможность восстановления психической деятельности человека.
Техника забора трансплантата. Вмешательство осуществляется бригадой хирургов в условиях операционной. Необходимо участие анестезиолога для обеспечения адекватной гемодинамики и вентиляции легких донора на время забора трансплантата, а также своевременного начала перфузии печени. Длительность забора трансплантата в некоторых случаях достигает 3 ч, что требует анестезиологического обеспечения, как для большой полостной операции (P. D. Taylor, 1981). В качестве доступа к печени используют поперечную лапаротомию на уровне девятого-десятого межреберья до средней подмышечной линии с обеих сторон, а при узкой грудной клетке и остром реберном угле дополнительно производят срединную лапаротомию от пупка до уровня поперечного разреза (R. Y. Calne, 1978). При заборе печени необходим тщательный гемостаз во всех местах рассечения ее связок. Обычно этого достигают поэтапной диатермокоагуляцией сосудов.
Во время забора производят перфузию печени специальным охлажденным раствором. Канюлируют воротную вену доступом через верхнюю брыжеечную вену непосредственно у корня брыжейки поперечной ободочной кишки. Для оттока перфузата рассекают переднюю стенку нижней полой вены над печенью или же канюлируют подпеченочный сегмент нижней полой вены, а надпеченочный пережимают (Т. Е. Starzl, 1969; R. Y. Calne и соавт., 1979).
Последовательно рассекают серповидную и треугольные связки печени, пересекая их на расстоянии от печени, чтобы в дальнейшем использовать для фиксации трансплантата у реципиента.
Выделяют и пересекают элементы печеночно-дуоденальной связки.
Для облегчения идентификации желчных протоков, особенно если имеется аномалия их расположения и слияния, рекомендуют пунктировать желчный пузырь и вводить в него изотонический раствор натрия хлорида (Т. Е. Starzl, 1969). В связи с возможностью краевого некроза желчного протока на уровне его пересечения необходимо бережное выделение его без излишней травматизации и деваскуляризации стенки (R. Y. Calne, R. W. Williams, 1979). Авторы не перевязывают проток и обращают внимание на кровоточивость стенки его в месте пересечения. Если после трансплантации кровотечение незначительное или отсутствует, пересекают проток на более высоком уровне.
Пересекают правую желудочную и гастродуоденальную артерии. Острым путем выделяют общую печеночную артерию до чревного ствола и на этом уровне пересекают. При малом диаметре артерии перевязывают селезеночную и левую желудочную артерии, а печеночную вместе с чревным стволом и площадкой аорты вблизи устья чревного ствола включают в трансплантат.
Далее смещают книзу двенадцатиперстную кишку и поджелудочную железу и выделяют воротную вену на всем ее протяжении. Мелкие вены — левую желудочную, если она впадает в воротную, и ветвь от головки поджелудочной железы — перевязывают.
Затем приступают к выделению подпеченочного сегмента нижней полой вены. Последнюю сохраняют на протяжении до уровня почечных вен. При этом необходимо перевязать правую надпочечниковую вену, которая впадает в нижнюю полую вену непосредственно ниже печени.
Заключительный этап — выделение надпеченочного сегмента нижней полой вены. Поскольку поддиафрагмальный участок сосуда очень короток, прибегают к диафрагмотомии, перикардото-мии, а вену пересекают на уровне впадения ее в правое предсердие (R. Y. Calne и соавт., 1979). Диафрагмальные вены, впадающие в нижнюю полую вену, пересекают и перевязывают. Оставление этих вен неперевязанными сопровождается профузным кровотечением после пересадки и чревато опасностью воздушной эмболии.
Печень извлекают из брюшной полости и помещают в контейнер.
Консервация печени. Первые экспериментальные и клинические попытки консервации печени осуществлялись с применением перфузии и охлаждения ее. Однако это часто приводило к отеку или ишемическому повреждению печени. Кроме того, это технически сложные методы (М. С. Маргулис и соавт., 1972; В. И. Шумаков и соавт., 1981).
Более удобными и в то же время достаточно эффективными являются следующие методы сохранения печени: 1) помещение ее в ледяной раствор после отмывания сбалансированным раствором электролитов; 2) то же в сочетании с прерывистой перфузией печени (R. Y. Calne, 1977). Первый метод позволяет сохранить жизнеспособный трансплантат на срок до 8—10 ч, а второй — на более длительный период.
Для перфузии и отмывания печени используют раствор Collins или аналогичные ему растворы.
Методику отмывания печени описал R. Y. Calne (1978) Через воротную вену вводят 1500 мл раствора Рингера-лактата при температуре 0°С, а затем — плазму крови. Печень удаляют и помещают в сосуд, содержащий ледяной солевой раствор. Дополнительно через воротную вену вводят 400 мл перфузата, а затем через печеночную артерию —еще 150 мл перфузата. После этого печень извлекают из сосуда и помещают в двойной полиэтиленовый мешок, который в свою очередь устанавливают в контейнер со льдом и транспортируют. Описанный метод консервации применен в 27 случаях, длительность ишемии колебалась от 2 до 10,5 ч, после пересадки все трансплантаты функционировали хорошо.
Несколько иную методику применил P. D. Taylor (1981). Промывание воротной вены производят 3—5 л раствора Рингера-лактата при температуре 4—10°С. Раствор поступает в печень под действием собственной массы органа. После окончания перфузии пересекают собственную печеночную артерию, артериальную перфузию не проводят. Автор подчеркивает необходимость предотвращения попадания пузырьков воздуха в воротную вену трансплантата во избежание эмболии мелких ветвей и неадекватного отмывания органа.
Показано, что премедикация донора феноксибензамином и хлорпромазином увеличивает толерантность печени к ишемии (R. Y. Calne и соавт., 1970).
Техника пересадки печени. Существует два принципиально различных метода пересадки печени: ортотопический и гетеротопиче-ский. Наибольшие успехи достигнуты при использовании ортотопической трансплантации.
Ортотопическая пересадка печени. Во время первых операций применяли торакоабдоминальный доступ, а впоследствии — поперечный разрез брюшной стенки на уровне восьмого-одиннадцатого межреберий, дополняя его иногда пересечением реберной дуги (Т. Е. Starzl, 1969).
Осуществляют мобилизацию печени реципиента. Серповидную и треугольные связки пересекают максимально близко к поверхности печени. Общий желчный проток выделяют и пересекают максимально высоко в воротах печени. Выделяют и пересекают собственную печеночную артерию и воротную вену как можно ближе к месту бифуркации их. Выделяют и пересекают под- и надпеченочный сегменты нижней полой вены. Учитывая малую длину над-печеночного сегмента нижней полой вены, рекомендуют пересекать печень на протяжении нескольких сантиметров и выделять участок сосуда, достаточный для формирования впоследствии анастомоза (R. Y. Calne, 1984).
После описанных манипуляций печень реципиента удаляют и приступают к вшиванию трансплантата.
Вначале сшивают концы надпеченочных сегментов нижней полой вены. Для большей герметичности, особенно задней стенки, предлагают накладывать двухрядный анастомоз (Т. Е. Starzl, 1969). Затем сшивают подпеченочные отрезки нижней полой вены донора и реципиента, после чего становится возможным восстановление кровотока по нижней полой вене. Последовательно восстанавливают проходимость воротной вены и собственной печеночной артерии и снимают зажимы с них, возобновляя кровоток в трансплантате.
Для профилактики воздушной эмболии во время пересадки медленно перфузируют солевой раствор через воротную вену (I E. Starzl и соавт., 1979). Герметичное закрытие нижней полом вены производят только после того, как через остаточное отверстие перестают выходить пузырьки воздуха.
Отличную от описанной очередность наложения сосудистых анастомозов применял R. Y. Calne (1978). Вначале сшивают надпеченочный сегмент нижней полой вены, а затем воротную вену. Перед окончанием наложения последнего анастомоза в воротную вену вводят 500 мл протеина при комнатной температуре, чтобы удалить из печени скопившиеся метаболиты и ионы калия, которые могут оказать токсическое действие при попадании в общий кровоток. Оттекающий через подпеченочный сегмент нижней полой вены в брюшную полость перфузат удаляют электроотсосом. После этого нижнюю полую вену ниже печени пережимают, а зажимы с надпеченочного сегмента нижней полой вены снимают и последовательно восстанавливают проходимость нижней полой вены и собственной печеночной артерии. Такая методика направлена на быстрейшее прекращение ишемии трансплантата.
Конечным этапом операции является восстановление оттока желчи. Опыт показал, что наиболее свободный желчеток достигается после сшивания протока по типу «конец в конец» на Т-образном дренаже (рис. 37).
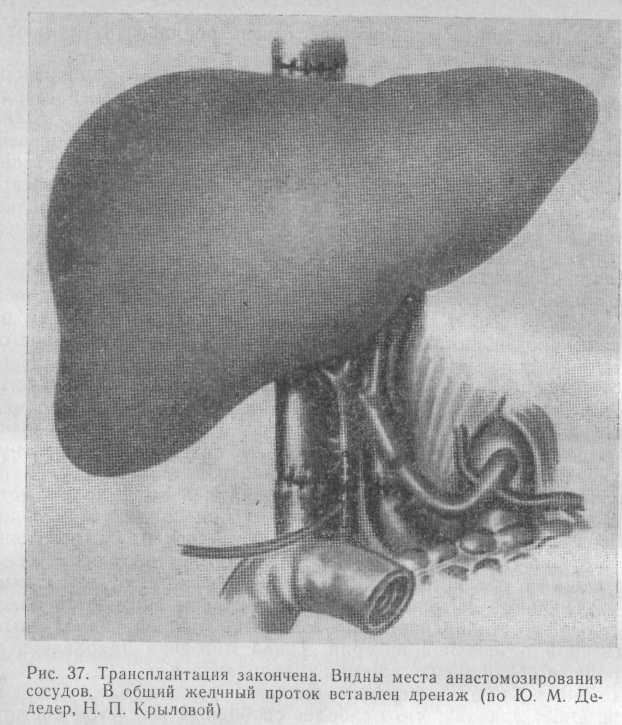
При невозможности наложения билио-билиарного анастомоза вследствие резкого несоответствия протока реципиента и донора показано создание билиодигестивного анастомоза с изолированной по Ру петлей тощей кишки (R. Y. Calne, 1978).
Связки печени реципиента и донора сшивают непрерывными или отдельными кетгутовыми швами. Брюшную полость ушивают наглухо или дренируют подпеченочное пространство резиновой трубкой (Т. Е. Starzl, 1977; R. Y. Calne, 1978).
Во время первых пересадок на период пережатия нижней полой вены реципиента применяли наружное бедренно-яремное шунтирование. Однако в дальнейшем по мере совершенствования анестезиологической техники стало возможным отказаться от него и ограничиться простым пережатием сосудов. Было показано, что наполнение венозного русла до уровня центрального венозного давления 180—200 мм вод. ст. обеспечивает безопасность пережатия нижней полой вены на срок до 120 мин и более (Т. G. Fortner и соавт., 1977).
В целях установления адекватности заполнения венозного русла осуществляют пробное пережатие надпеченочного сегмента нижней полой вены реципиента (R. Y. Calne, 1978). Если эта манипуляция сопровождается прогрессирующим падением сердечной деятельности, зажим снимают и дополнительно вводят внутривенно до 1 л растворов, после чего манипуляцию повторяют. Автор указывает, что период от пережатия сосудов до удаления печени должен быть максимально коротким во избежание поступления крови из ишемизированной печени в общий кровоток, что чревато опасностью развития гиперкалиемии.
Во время операции больному вводят растворы глюкозы, поддерживая уровень глюкозы в крови 8,3—19,4 ммоль/л, и натрия гидрокарбоната из расчета 2,5 ммоль/ч и дополнительно 10 ммоль на каждый литр перелитой цитратной крови (Т. Е. Starzl, 1974; Calne и соавт., 1979). Дополнительно вводят 300—400 мг кальция хлорида.
Для коррекции сниженного артериального давления во время постановления кровотока в трансплантате рекомендуют переливать до 3 л крови за 5 мин, используя одновременно несколько вен (R. Y. Calne и соавт., 1979).
Наиболее тяжелым осложнением пересадки печени, дающим большое число неудовлетворительных результатов, оказалось кровотечение из анастомозированных и (или) неперевязанных сосудов (Т. Е. Starzl и соавт., 1979). Лишь совершенствование техники операции и приобретение соответствующих навыков позволили эффективно предупреждать кровотечение. На объем кровопотери значительное влияние оказывал характер основного заболевания реципиента. Он особенно велик у больных циррозом печени.
Кроме погрешностей в хирургической технике, причинами боль, шок, кропопотери могут быть нарушения свертывания крови. Оно особенно выражено при пересадке ишемизированного трансплантата. Наблюдается прогрессирующая тромбоцитопения, возрастает фибринолитическая активность крови. Для устранения нарушения свертывания крови назначают тромбоцитарную массу, аминокапроновую кислоту, фибриноген, протамина сульфат, переливание больших количеств теплой донорской крови (R. Y. Calne и соавт., 1979).
Возможно тромбирование артериального анастомоза уже через несколько минут после его наложения. Это проявляется изменением окраски печени на темно-синюю. Для устранения тромбоза необходимы ревизия анастомоза и тромбэктомия (Т. Е. Starzl, 1969). Следует также оценить условия кровотока и при наличии показаний сформировать новый артериальный анастомоз.
Анестезиологическое обеспечение. С точки зрения анестезиологии выделяют 4 этапа операции пересадки печени (Т. Shido и соавт., 1981).
Первый этап — выделение собственной печени реципиента. Характеризуется обильной кровопотерей.
Второй этап — «беспеченочная» стадия. Резко сокращается поступление крови к сердцу в результате пережатия нижней полой вены.
Третий этап — частичная реваскуляризация пересаженной печени. Изменяются уровень электролитов, особенно калия, кислотно-основное состояние и свертывание крови. Это находит свое отражение в понижении температуры тела больного до 32 °С и ниже.
Четвертый этап — в результате восстановления кровотока по нижней полой вене повышается центральное венозное и систолическое давление, возникает метаболический ацидоз.
Иммунодепрессантная терапия. Клинический опыт показал, что для купирования реакции отторжения трансплантата печени доза иммунодепрессантов не должна быть очень высокой. Назначают азатиоприн по 1—5 мг/кг, преднизолон по 0,4—1,5 мг/кг (В. И. Шумаков и соавт., 1981).
Существенное улучшение результатов пересадки печени отмечалось после введения в клиническую практику циклоспорина А (Т. Е. Starzl и соавт., 1981). Препарат назначают по 17,5 мг/кг в сутки, начиная со дня операции. Через 6—8 нед суточную дозу уменьшают до 10 мг и менее.
Однако циклоспорин А оказывает токсическое действие на почки.
Кризы отторжения проявляются ухудшением общего состояния, появлением желтухи, асцита и других признаков печеночной недостаточности (Т. Е. Starzl и соавт., 1979).
Для оценки интенсивности реакции отторжения используют чрескожную чреспеченочную биопсию печени (Т. Е. Starzl и соавт., 1979).
Гетеротопичеекая пересадка печени. Предложено много вариантов гетеротопической пересадки печени. В клинической практике используют следующие виды пересадки печени: 1) забрюшинное пространство справа ниже почки; 2) на место удаленной правой почки; 3) в правую подвздошную область; 4) на место удаленной селезенки; 5) на место удаленной левой почки; 6) в левую подвздошную ямку; 7) в область бедренного треугольника (В. И. Шумаков и соавт., 1981).
Однако эффективность гетеротопической пересадки печени низкая.
Сегментарность строения печени позволяет производить пересадку не всего органа, а части его. Описаны клинические наблюдения подобных операций (В. И. Шумаков и соавт., 1978; Т. Веаulieux, 1976, и др.).
Эффективность таких пересадок еще ниже, чем гетеротопической пересадки целого органа.
Date: 2015-09-18; view: 668; Нарушение авторских прав