
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 4. АБСЦЕССЫ ПЕЧЕНИ
|
|
Непаразитарные абсцессы печени наблюдаются у 4,9—5,1 больных из 10 000 госпитализированных (J. Neoptolemos и соавт., 1982). По данным И. Н. Гришина и соавторов (1990), частота этой патологии в общем хирургическом стационаре составляет 0,5 %. Абсцессы печени наблюдаются в любом возрасте, чаще они встречаются у женщин в возрасте 30—60 лет (Ф. И. Тодуа и соавт., 1990; С. А. Шалимов и соавт., 1991).
Этиология и патогенез. Причинами возникновения абсцесса печени являются: 1) разрыв паренхимы с образованием внутрипеченочной гематомы; 2) гнойный холангит вследствие нарушения проходимости желчных протоков доброкачественного и злокачественного генеза; 3) переход гнойного воспаления с желчного пузыря; 4) гематогенный занос инфекции при сепсисе или гнойно-воспалительном очаге в брюшной полости; 4) паразитарное поражение; 6) специфические инфекции; нагноение кист печени.
Абсцессы печени, происхождение которых не связано с паразитарной инвазией, называют непаразитарными, или пиогенными. Важную роль в развитии пиогенных абсцессов играет уменьшение сопротивляемости организма, наступающее при заболеваниях органов кроветворения и других иммунодефицитных состояниях. У больных пожилого возраста существенное значение имеет хроническая гнойная инфекция желчевыводящих путей.
Р. П. Аскерханов и Н. Г. Мартыненко (1978), выполнившие 272 операции по поводу абсцессов печени, указывают, что у 64,7 % больных они были амебного происхождения, у 12,5 % —эхинококкового, у 6,5 % — бактериального (вследствие дизентерии, протейного гнилостного колита, флегмонозного аппендицита, холецистита), у 5,2% — холангического, у 1,8%—травматического, у 0,4 % —лямблиозного. В то же время J. Neoptolemos и соавторы (1982) наблюдали абсцессы печени аппендикулярного происхождения у 32 % больных, а холангиогенного — у 39 %. Редкой патологией считаются первичные туберкулезные абсцессы печени. По данным К. Ninoch и соавторов (1976), в мировой литературе описано лишь 98 подобных наблюдений. В то же время у 4—11 % больных непосредственную причину образования абсцессов печени установить не удается (J. Casula и соавт., 1981).
И. Н. Гришин и соавторы (1990) наблюдали 36 больных о абсцессами печени. Пиогенные абсцессы были у 30 больных, паразитарные— у 4; у 2 больных этиология абсцесса не установлена.
Авторы отмечают, что основными причинами абсцедирования являются острый холецистит, холангит, сепсис.
Абсцессы печени обычно возникают через 3—4 нед после травмы в результате нагноения внутрипеченочных гематом. Сроки появления холангиогенных абсцессов печени установить трудно, поскольку им обычно предшествует длительно текущий нередко ре-цивидирующий гнойный холангит. То же можно сказать об абсцессах, развивающихся вследствие перехода воспаления с желчного пузыря на печень. Мы наблюдали такое осложнение через 18 сут после первого приступа острого холангита и у длительно болеющих желчнокаменной болезнью.
Гематогенный занос инфекции может осложниться формированием абсцесса печени уже через 10 сут после развития септического состояния или гнойного воспаления в органах брюшной полости.
Рост микроорганизмов при бактериологическом исследовании гноя обнаруживается у большинства больных; чаще это кишечная палочка, иногда анаэробы, редко обнаруживаются микроорганизмы у больных, получавших интенсивную антибактериальную терапию.
Амебные абсцессы печени чаще возникают в первые 3 мес после дизентерии (И. К. Пипиа, 1972). Попадая с током крови по воротной вене в печень, амебы внедряются в паренхиму и вызывают образование инфильтратов. Нередко течение процесса усугубляется тромбозом ветви воротной вены, приносящей кровь к этому участку печени. Под действием паразитов наступает лизис гепатоцитов с образованием полостей, заполненных красновато-коричневым («шоколадным») гнойным содержимым. Иногда содержимое амебных абсцессов окрашено в белый цвет. Амебы обнаруживают в полости абсцесса лишь у 1/3 больных.
Патологическая анатомия. Развитие внутрипеченочного абсцесса характеризуется расширением близлежащих вен, периферической воспалительной реакцией паренхимы печени и образованием полости в центре. В начале болезни абсцесс отграничен от окружающей ткани серовато-красной мембраной, которая затем утолщается и превращается в плотную капсулу.
Локализация холангиогенных абсцессов печени отражает ветвление желчных протоков. Типичны воспалительные изменения стенок последних, гнойное содержимое в просвете протоков.
Абсцессы печени, возникающие в результате прямого распространения гнойного воспаления с желчного пузыря, чаще одиночные и расположены непосредственно вблизи ложа пузыря. Однако длительное течение болезни может привести к дальнейшему проникновению микроорганизмов в паренхиму печени. Вследствие этого образуются толстостенные многокамерные абсцессы (1 наше наблюдение).
Р. П. Аскерханов и Н. Г. Мартыненко (1978) выявили одиночные гнойные абсцессы печени у 87,5 % больных, множественные —у 12,5 %. И. Н. Гришин и соавторы (1990) множественные абсцессы наблюдали у 6, а единичные — у 28 из 33 наблюдаемых больных. Абсцесс локализовался в правой доле печени у 80,2 % больных, в левой — у 14,7%, в обеих — у 5,1 %. Множественные абсцессы у 38 % больных имеют холангиогенную причину (С. А. Шалимов и соавт., 1991).
У 5 из 7 больных, у которых были выявлены микроорганизмы в крови, обнаружены множественные абсцессы печени (С. Frey и соавторы, 1980).
Множественные амебные абсцессы встречаются в 8,6—20 % наблюдений (И. К. Пипиа, 1972). Микроскопически различают три зоны поражения: 1) некротизйрованные ткани в центре; 2) средняя зона с разрушенными паренхиматозными клетками, но с сохранившейся стромой; 3) визуально нормальная ткань печени, в которой обнаруживаются амебы.
Гистологическое исследование ткани печени на границе абсцесса является наиболее достоверным методом диагностики туберкулезного поражения.
Содержимое амебных и туберкулезных абсцессов печени обычно не имеет запаха, в то время как гнойно-гнилостные процессы вызывают характерный неприятный запах.
Клиника. Анамнестические данные и клиническое течение основного заболевания в большинстве случаев помогают определить наличие в организме гнойного очага. К таким заболеваниям относятся острый холецистит, гнойный холангит, травма печени, септическое состояние, острый аппендицит, амебиаз и другие остро возникающие заболевания органов брюшной полости. Хотя возникновение абсцесса печени изменяет клиническое течение основного заболевания, однако тщательно собранный анамнез необходим еще и для выбора вспомогательных методов обследования — урографии, холецистографии, иммунологических тестов и т. п. Проведение этих исследований, в свою очередь, служит залогом целенаправленного и патогенетически обоснованного лечения.
Наиболее характерным симптомом абсцесса печени является лихорадка гектического или постоянного типа с повышением температуры тела до 39—40 °С и более. Подъем температуры сопровождается сильным ознобом, а снижение ее — проливным потом, изнуряющим больного.
Одновременно прогрессируют общая слабость, отсутствие аппетита. Нередко бывают тошнота, рвота.
Желтушность склер и слизистых оболочек выявляется в первые дни болезни более чем в 50 % наблюдений, однако позже она нередко исчезает (О. Б. Милонов, О. Г. Бабаев, 1972; Ф. И. Тодуа и соавт., 1990). Иктеричность склер и кожи М. А. Козырев
и соавторы (1990) наблюдали у 69 % больных с абсцессами печени.
Боль обычно средней интенсивности, локализуется в надчревной области и (или) в правом подреберье. Иногда боль иррадиирует в правую лопатку и в правое плечо, она не связана с приемом пищи. Понос, иногда с примесью крови, нередко бывает у больных амебиазом.
Через 2—3 нед возникают пастозность и даже отечность стоп и голеней, гепатомегалия, асцит.
При пальпации живота обнаруживают увеличение и болезненность печени, чаще более выраженные в той доле, где локализуется абсцесс. Боль усиливается при глубоком вдохе на фоне пальпации края печени.
Различают три типа болезни:
I — ухудшение самочувствия, снижение массы тела, желтуха сочетается с ознобом, болью в животе, напряженной увеличенной печенью;
II—симптомы абсцесса печени маскируются клиническими проявлениями предшествующего заболевания;
III — заболевание развивается исподволь, нет четких клинических проявлений. Последний тип течения болезни характерен для абсцессов печени, возникающих на фоне заболеваний крови или других иммунодефицитных состояний.
Длительное существование непаразитарного абсцесса печени может сопровождаться рядом гнойно-септических осложнений. Наиболее часто наблюдаются септицемия, экссудативный плеврит, реже — бронхопневмония, ателектаз нижней доли легкого, эмпиема плевры, околопеченочные абсцессы (чаще справа), в единичных случаях—менингит, аррозивное кровотечение. Более тяжелым осложнением абсцесса печени является прорыв гноя в брюшную полость. В зависимости от локализации места прорыва гнойное содержимое попадает или в относительно ограниченное подди-афрагмальное пространство чаще справа, или в свободную брюшную полость, давая начало развитию местного или общего перитонита.
По данным Р. П. Аскерханова и Н. Г. Мартыненко (1978), из 326 больных с абсцессами печени прорыв гнойного содержимого в свободную брюшную полость наступил у 16 больных, в под-диафрагмальное пространство — у 10, в плевральную полость — у 8, в желчный пузырь и в поперечную ободочную кишку — у 2. При оперативном лечении прорвавшихся в брюшную полость абсцессов висцеральной поверхности печени смертность достигает 60 % (М. 3. Загидов, 1990).
Диагностика. Общий анализ крови определяет некоторое снижение количества эритроцитов, обусловленное общей интоксикацией и угнетением кроветворения. Количество лейкоцитов увеличено, иногда до 40-109/л и более, резко выражен сдвиг лейкоцитарной формулы влево вплоть до появления миелоцитов. СОЭ значительно увеличена. Выраженность перечисленных изменений прямо пропорциональна длительности болезни. Общий анализ мочи отражает изменения, типичные для тяжелой токсемии, появление белка и цилиндров. При посеве крови на стерильность рост микроорганизмов обнаружен у 65,2 % наблюдаемых нами больных, чаще при множественных абсцессах. При биохимических исследованиях крови отмечено повышение концентрации билирубина, активности трансаминаз. Уровень С -реактивного белка отражает нарушение функции печени, но неспецифичен для данного заболевания.
Длительное септическое состояние, обусловленное абсцессом печени, приводит к понижению свертывания крови за счет уменьшения содержания в крови начальных компонентов свертывания.
Выраженность изменений биохимического состава крови обусловлена как длительностью существования абсцесса печени, так и характером предшествующей патологии.
Иммунологические тесты указывают на значительное снижение сопротивляемости организма (Р. П. Аскерханов, Н. Г. Мартыненко, 1978).
Специфические антигены обнаружены методом иммунного электрофореза у 97,2%, методом непрямой гемагглютинации — у 94,4 % из 107 больных с амебными абсцессами печени (R. Disro, Ih. Sebinkel, 1979).
Обзорное рентгенологическое исследование устанавливает увеличение размеров печени, уменьшение подвижности правого купола диафрагмы. При локализации абсцесса вблизи диафрагмаль-ной поверхности печени развиваются реактивный плеврит и перикардит.
Подвижность диафрагмы может быть ограничена в определенном участке ее, что облегчает установление локализации абсцесса (Л. Д. Линденбратен, 1980). Косвенные патологические признаки были обнаружены при обзорном рентгенологическом исследовании грудной клетки у 38%, брюшной полости — у 35% больных с абсцессами печени (М. А. Козырев и соавт., 1990).
Прямой рентгенологический признак абсцесса печени — полость с уровнем жидкости и газ над ней в проекции печени. Очаги обызвествления в печени и селезенке, наряду с характерной клинической картиной абсцесса, могут свидетельствовать о бруцеллезе (Л. Д. Линденбратен, 1980). Подобную картину мы наблюдали у больной с нагноившейся эхинококковой кистой печени.
Радиологическое исследование с I98Au или 98Тс устанавливает зоны с отсутствием накопления радионуклида в месте абсцесса.
Ультразвуковая эхолокация выявляет абсцессы печени только в тех случаях, когда имеется различная плотность содержимого абсцесса и окружающей паренхимы (рис. 23).
М. Н. Новикова (1986) доказала, что акустическая стриктура и размеры гнойных полостей в печени не зависят от сроков их формирования, а также вызвавших причин. По данным автора, эхографическое изображение внутрипеченочных абсцессов, как правило, имеет пониженную эхогенность и акустически неоднородно.
Только у 25—30 % были визуализированы абсцессы с акустически однородным содержимым, причем одинаково часто наблюдалась повышенная и пониженная эхогенность.
М. Н. Новикова (1986) отметила также, что эхографически не всегда легко дифференцировать внутрипеченочные и околопеченочные абсцессы. Диагноз абсцесса полностью подтверждается после получения гноя путем пункции под контролем ультразвука.
Артериография печени обнаруживает дугообразное оттеснение артерий в месте абсцесса с зоной гиперваскуляризации вокруг него и аваскулярным участком в центре (Е. Martin и соавт., 1981). Артериографическая картина, по мнению авторов, сходна с таковой при опухолях, что требует тщательной дифференциальной диагностики.
По данным Н. Rubinsen и соавторов (1980), компьютерная томография выявила абсцесс печени у 15 из 17 больных. Авторы указывают, что последовательное применение сцинтисканирования и ультразвуковой эхолокации по информативности не уступает компьютерной томографии в диагностике рассматриваемой патологии.
Оценка проходимости желчных протоков обязательна в тех случаях, когда не исключена холангиогенная природа абсцесса печени. Это обусловлено тем, что без восстановления свободного оттока желчи эффективное лечение подобных абсцессов невозможно. Методы оценки проходимости желчных протоков будут рассмотрены в главе «Непроходимость желчных протоков доброкачественной этиологии».
Тактика лечения абсцесса печени зависит от следующих факторов.
I. Количество абсцессов: а) одиночные, б) множественные.
II. Величина абсцессов: а) большие, б) малые.
III. Возбудитель:
а) бактериальный, б) паразитарный, в) специфический.
IV. Наличие осложнений и сопутствующих заболеваний:
а) неосложненные, б) осложненные или связанные с сопутствующим заболеванием. Лечение. Медикаментозная терапия является вспомогательным
методом лечения абсцессов печени. Вместе с тем, она играет важную роль в достижении выздоровления больного.
Рациональным назначением антибиотиков, как правило, удается локализовать множественные, но мелкие абсцессы в случае восстановления проходимости магистрального желчеоттока. Вместе с тем, даже длительная антибиотикотерапия не приводит к сколько-нибудь заметному уменьшению больших абсцессов.
До получения бактериограммы и сведений о чувствительности микроорганизмов к антибиотикам рекомендуется назначать производные аминогликозидов (канамицина сульфат, мономицин, гентамицина сульфат) или цефалоспорины в сочетании с антианаэробными препаратами (метронидазол или линкомицина гидрохлорид). После получения бактериограммы антибактериальную терапию проводят целенаправленно.
Тяжесть состояния больных с абсцессом печени требует проведения интенсивной инфузионной терапии до операции. Такая мера необходима даже в тех случаях, когда предполагается максимальное вмешательство в виде чрескожной пункции абсцесса. Интенсивная терапия направлена в первую очередь на восстановление объема циркулирующей крови, уменьшение содержания альбумина в крови, борьбу с анемией. Назначают 5 или 20 % раствор глюкозы с инсулином из расчета 1 ЕД на 4 г сухого вещества (до 800—1200 мл), 10 % раствор альбумина или другие белковые препараты (до 200—400 мл), гемодез (400 мл), переливание крови (250—500 мл). Внутривенно вводят антибиотики широкого спектра действия, обычно цепорин, в максимальной дозировке. При резко выраженных признаках общей интоксикации и печеночной недостаточности указанные дозы (кроме антибиотиков) увеличивают в 2—3 раза, назначают 150—200 мл 20 % раствора маннита или до 120 мг лазикса в целях форсирования диуреза.
Интенсивная медикаментозная подготовка требуется особенно в тех случаях, когда предполагается прорыв абсцесса в брюшную полость.
Отказ или неполноценное осуществление интенсивной терапии значительно ухудшает прогноз хирургического лечения и может привести к летальному исходу в 1-е сутки после операции.
Медикаментозное лечение амебных абсцессов печени ранее проводили эметином. В настоящее время более эффективным считают метронидазол (К. Singh и соавт., 1977). Препарат вводят по 0,75 г 3 раза в сутки самостоятельно или в сочетании с тетрациклинами в течение 7 сут.
Консервативную терапию после хирургического вмешательства проводят в целях подавления роста и размножения возбудителей заболевания, а также для борьбы с печеночной недостаточностью. Введение лекарственных препаратов в пупочную вену обеспечивает высокую концентрацию их в печени.
Бактериологическое исследование гноя можно проводить после пункции абсцесса или другого хирургического вмешательства. Результаты бактериограммы имеют важное значение в выборе средств антимикробного лечения. При выполнении бактериологического исследования необходимо учитывать, что возбудителями заболевания могут быть аэробные и анаэробные микроорганизмы, а также амебы и другие паразиты; возможно сочетание нескольких видов микроорганизмов.
Отсутствие роста микроорганизмов при посеве на обычный мясо-пептонный бульон или агар не свидетельствует о стерильности абсцесса, а лишь указывает на то, что возбудители заболевания не относятся к аэробным микроорганизмам. В этой ситуации как медикаментозное лечение, так и оперативное вмешательство необходимо проводить таким образом, чтобы они были эффективными как в отношении анаэробной микрофлоры, так и в отношении амебиаза (Ph. Simon и соавт., 1977).
Аскаридные и лямблиозные абсцессы печени удается диагностировать лишь по обнаружению в гное мертвых паразитов (Р. П. Аскерханов, Н. Г. Мартыненко, 1978).
Гистологическое исследование стенки абсцесса обязательно. Результаты его имеют наибольшее значение в диагностике туберкулезного абсцесса, а также в дифференциальной диагностике абсцесса, опухолевого распада и вторичного инфицирования.
Хирургическое лечение. До внедрения в клиническую практику ультразвукового исследования и компьютерной томографии диагностика абсцессов печени носила предположительный характер, поэтому показание к хирургическому лечению основывалось на диагностичееких критериях, указывающих на наибольшую вероятность такой патологии.
Разработка и внедрение в клиническую практику методов ультразвукового исследования и компьютерной томографии не только открыли новые возможности для диагностики, но и изменили традиционные подходы к лечению путем более широкого применения закрытых методов — чрескожной пункции и дренирования.
О широком внедрении экономных методов чрескожной пункции и дренирования абсцессов под контролем ультразвукового исследования и компьютерной томографии сообщают Ф. И. Тодуа и соавторы (1990), И. Н. Гришин и соавторы (1990), М. А. Козырев и соавторы (1990), В. Е. Медведев и соавторы (1991).
Пункцию абсцессов под контролем эхографии большинство авторов (М. Н. Новикова, 1986; В. Е. Медведев и соавт., 1991) производят с использованием ультразвукового диагностического аппарата SSD-256, снабженного пункционным датчиком, в котором имеется отверстие для прохождения иглы.
Пункцию производят через межреберные промежутки в положении больного на левом боку либо через переднюю брюшную стенку в положении на спине под местной анестезией.
Содержимое непаразитарных абсцессов представляет собой сливкообразный гной с неприятным запахом, амебных абсцессов — жидкость без запаха «шоколадного» цвета.
Определение размеров абсцесса и сообщения его с желчными протоками возможно после введения контрастного вещества, иногда с примесью воздуха.
Однократная пункция амебного абсцесса печени в сочетании с медикаментозной терапией часто позволяет добиться выздоровлении больных (О. Б. Милонов, О. Г. Бабаев, 1972).
Однако при непаразитарных абсцессах однократной аспирации их содержимого обычно недостаточно и приходится выполнять повторные пункции. В настоящее время более целесообразным считают чрескожное дренирование абсцесса путем установления катетера в его полость (В. Е. Медведев и соавт., 1990).
Чрескожное пункционное дренирование абсцесса печени (рис. 24) показано при четко установленной локализации единичного гнойника.
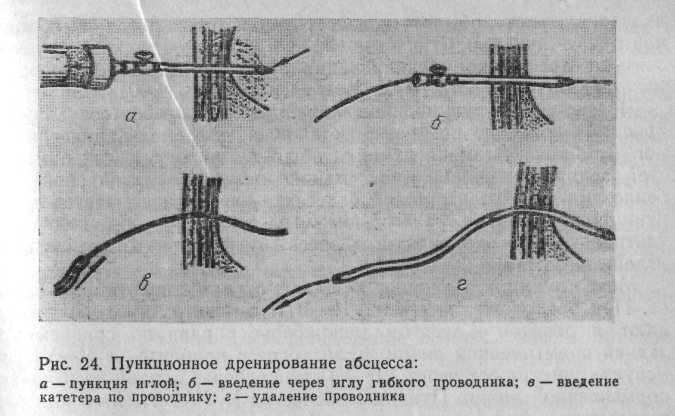
Техника пункции абсцесса такая же, как при простой аспирации содержимого, однако вязкий и густой гной, особенно при непаразитарных абсцессах, плохо отсасывается через пункционную иглу малого диаметра, поэтому под контролем ультразвуковой эхолокации абсцесс пунктируют более толстой иглой диаметром 1,2—2 мм.
Место пункции выбирают в зависимости от локализации абсцесса. При расположении его в VII—VIII сегментах пункцию выполняют в девятом — десятом межреберье справа по средней или задней подмышечной линии. Если абсцесс находится в V—VI сегментах, пунктируют через VI—VII межреберье справа по передней подмышечной линии. Пункцию абсцессов I—IV сегментов или расположенных у нижнего края печени в V—VI сегментах производят через ближайшую точку в надчревной области. Если гной очень вязкий и плохо отсасывается, его разжижают, вводя в полость абсцесса изотонический раствор натрия хлорида. После аспирации гноя в полость абсцесса вводят металлическую струну-проводник. Иглу извлекают, а по струне в полость абсцесса проводят трубчатый дренаж с несколькими боковыми отверстиями. Дренаж фиксируют к коже отдельным швом. Через дренаж вводят водорастворимое контрастное вещество, оценивают размеры гнойной полости и адекватность проведенного дренирования.
В дальнейшем дренаж используют для введения в полость абсцесса антибиотиков, а также для механического промывания полости. Подобное лечение оказалось эффективным у 3 из 5 больных с непаразитарными абсцессами печени (Е. Martin и соавт 1981).
Неэффективность метода отмечена в случае наличия секвестров некротизированной ткани в полости абсцесса, которые не могли быть эвакуированы через дренаж, а также с периодическим выделением желчи. В. Е. Медведев и соавторы (1991), анализируя результаты пункций 84 абсцессов отмечают, что они не наблюдали серьезных осложнений этих манипуляций.
Вскрытие и дренирование абсцесса печени через верхне-срединный разрез или через разрез в правом подреберье выполняют при очень больших абсцессах, самопроизвольном вскрытии абсцесса в брюшную или плевральную полость, при наличии в полости некротических масс, детрита, что делает невозможным полноценную санацию его, а также при наличии кровотечения в полость абсцесса.
Такой доступ удобен также для дренирования абсцессов, локализующихся в I—III сегментах печени, а также предлежащих к передней и висцеральной поверхностям абсцессов IV—VI сегментов.
Преимущество широкого доступа заключается в возможности тщательной ревизии печени и других органов брюшной полости.
Недостатком такого доступа является опасность развития перитонита вследствие диссеминации инфекции. Поэтому необходимо тщательно соблюдать меры, предупреждающие распространение гноя. К ним относятся отграничение операционного поля салфетками и простынями, незамедлительное аспирирование электро-или вакуумным отсосом содержимого абсцесса после вскрытия или пункции его, смена операционного белья и одежды хирургической бригады, мытье инструментов после окончания этапов операции, дренирование абсцесса печени.
В тех случаях, когда возникновение абсцесса печени обусловлено распространением инфекции из желчного пузыря, вначале выполняют холецистэктомию. При холангиогенных абсцессах печени производят холедохотомию, удаляют имеющиеся конкременты и производят наружное дренирование общего желчного протока. Техника выполнения перечисленных вмешательств будет описана в главах «Желчнокаменная болезнь и заболевания желчного пузыря», «Непроходимость желчных протоков доброкачественной этиологии».
Наложение холедоходуоденоанастомоза 3 наблюдаемым нами больным с множественными холангиогенными абсцессами печени не позволило достичь купирования холангита и устранения абсцессов; все больные умерли. Наружный дренаж общего желчного протока, выполненный в аналогичных условиях, позволил добиться выздоровления 4 из 8 больных. Эти наблюдения свидетельствуют о преимуществе наружного дренирования общего желчного протока перед наложением холедоходуоденоанастомоза при лечении холангиогенных абсцессов печени.
При наличии множественных абсцессов печени, а также у больных с резко нарушенными функциями печени и угрозой развития печеночной недостаточности для проведения интенсивной инфузи-онной терапии катетеризируют пупочную вену.
В тех случаях, когда до операции локализация абсцесса печени не установлена, обнаружение его представляет значительные трудности. По данным J. Northover и соавторов (1982), абсцесс во время лапаротомии был обнаружен только у 3 из 6 больных; у остальных его нашли только при аутопсии. Пальпация печени, даже после широкой мобилизации ее, далеко не всегда информативна. Так, у 3 больных нам не удалось пальпаторно обнаружить абсцессы емкостью до 400 мл, расположенные в глубине паренхимы. Планомерное многократное пунктирование печени значительно повышает диагностические возможности. Используя этот метод, мы не обнаружили во время операции абсцесс печени только у 1 больного. Диагностическая ошибка была обусловлена тем, что длительное существование гнойного очага (более 7 мес) привело к формированию плотной капсулы, которая во время пункции была принята за ребро. В последние годы у 3 больных нам удалось выявить абсцесс с помощью методики информационного ультразвукового исследования. При отсутствии возможности проведения интраоперационного ультразвукового исследования необходимо многократное пунктирование печени. Каждый раз оценивают глубину погружения иглы (каждый сегмент печени должен быть пунктирован из нескольких точек 2—3 раза). Использование иглы диаметром 0,7 мм сводит риск повреждения сосудов и желчных протоков при этих манипуляциях до минимума. После обнаружения абсцесса его пунктируют иглой диаметром до 2 мм и аспирируют содержимое. Критерием полноты опорожнения абсцесса является уменьшение напряжения печени, отмечаемое непосредственно после эвакуации гноя. В тех случаях, когда после опорожнения абсцесса напряжение печени исчезает, допустимо так называемое закрытое дренирование. Сущность его заключается в том, что вблизи иглы скальпелем рассекают фиброзную оболочку печени на протяжении 0,5—1 см. По ходу иглы тупо проводят корнцанг или неострый троакар в полость абсцесса. По образованному каналу вводят трубчатый дренаж с 1—2 боковыми отверстиями в конечной его части. Дренаж фиксируют кетгутовым швом к фиброзной оболочке печени, а второй конец его выводят через контрапертуру на переднюю брюшную стенку и фиксируют отдельным швом к коже.
При объеме абсцесса более 40 мл считаем необходимым дренирование его двумя трубчатыми дренажами.
Если же после пункции и аспирации содержимого абсцесса видимого уменьшения напряжения не наступает, необходимо провести дополнительную ревизию для поисков второго абсцесса. Отсутствие спадения полости абсцесса также может быть следствием значительного уплотнения стенок его при длительном течении заболевания. В этих случаях необходимо широкое рассечение капсулы абсцесса, после чего определяют объем вмешательства (дренирование, оментопластика или резекция печени).
Для оценки размеров абсцесса, если она возможна по результатам предоперационного обследования, после аспирации гноя вводят через шприц контрастное вещество и выполняют рентгенологический снимок. Над иглой рассекают фиброзную оболочку печени на протяжении 5—7 см, тупо по игле проводят корнцанг в полость абсцесса. Пальцем выполняют ревизию полости, тампоном аккуратно собирают некротизированные ткани и удаляют их. По образованному каналу вводят два трубчатых дренажа. Если полость абсцесса большая, делают дополнительный канал в наиболее удаленном от первого месте и через него вводят еще 1—2 трубчатых дренажа. Дренажи выводят наружу через контрапертуру брюшной стенки и фиксируют кетгутовыми швами к капсуле печени и синтетической нитью — к коже. К месту выхода дренажей из печени в брюшную полость вводят дополнительный перчаточно-трубчатый дренаж, который также проводят через контрапертуру брюшной стенки и фиксируют к коже. Разрез, использованный в качестве операционного доступа, зашивают наглухо.
Через дренажи вводят антибиотики и промывают полость абсцесса растворами антисептиков в послеоперационный период. Состав препаратов подбирают в зависимости от вида возбудителей.
К. Singk и соавторы (1977) применяют для лечения вскрывшихся амебных абсцессов следующую методику дренирования. После санации полости абсцесса подводят гофрированные дренажи к месту прорыва гнойника из печени, а также по правому и левому фланкам брюшной полости в обе подвздошные ямки. Непосредственно в полость абсцесса дренаж не вводят. При отсутствии отделяемого дренажи удаляют через 3—5 сут после операции. Описанным методом авторы оперировали 21 больного и наблюдали 3 летальных исхода.
Оментопластика полости абсцесса целесообразна при единичных абсцессах печени с плотными стенками, когда после опорожнения гнойника не происходит спадения стенок и самостоятельная ликвидация остаточной полости невозможна.
Р. П. Аскерханов и соавторы (1984) выполнили 26 подобных операций и в 55 % случаев использовали оментопластику при лечении остаточных полостей печени различной этиологии. Авторы пришли к заключению, что эта операция, хотя и не является универсальной, но предупреждает образование хронических свищей и связанных с ними осложнений. Различают следующие способы оментопластики: закрытый, полузакрытый без иссечения и с иссечением излишков капсулы, а также пломбировка перфорационного отверстия лоскутом сальника. Сущность закрытого варианта операции заключается в том, что после лапаротомии, вскрытия и санирования полости абсцесса выбирают хорошо кровоснабжаемую прядь большого сальника и заполняют ею полость абсцесса, подшивая сальник отдельными кетгутовыми швами к краям полости после абсцессотомии. К месту подшивания большого сальника подводят перчаточно-трубчатый дренаж, свободный конец которого выводят через контрапертуру брюшной стенки.
Полузакрытый способ, который чаще используется при закрытии инфицированных полостей, отличается от предыдущего тем, что в полость наряду с прядью сальника вводят 1—2 микроирри гатора ко дну полости и один дренаж подводят к месту подшивания сальника. Дистальные концы выводят через контрапертуру брюшной полости наружу. Наиболее удобными для оментопласти-ки оказались полости, расположенные на нижней и передней поверхностях печени.
Наш опыт чрезбрюшинного доступа и дренирования абсцесса печени трубчатыми дренажами (18 наблюдений) показал, что опасность развития перитонита невелика, если во время оперативного вмешательства соблюдаются описанные выше требования. Однако полностью игнорировать возможность такого осложнения нельзя, особенно при наличии сопутствующих болезней крови, сахарного диабета, которые вызывают значительное угнетение реактивности организма. Поэтому выбор доступа должен быть дифференцированным в каждом конкретном случае. Мы у 2 больных провели дренаж через контрапертуру, выполненную в межреберье, наиболее близко расположенном к абсцессу, и фиксировали его отдельным швом к коже у места выхода.
Марсупиализация абсцесса, заключающаяся в том, что после вскрытия гнойной полости края печени подшивают отдельными швами к париетальной брюшине, создавая тем самым широкий путь для оттока гноя наружу, из-за высокой частоты осложнений (53,5 %, по данным Р. П. Аскерханова и Н. Г. Мартыненко, 1978), не может быть рекомендована для лечения абсцессов печени.
Доступ по Мельникову, а также доступ по передней или средней подмышечной линии через ложе резецируемого ребра (VII, VIII, IX или X) используют в тех случаях, когда на основании предоперационного обследования точно установлено наличие единичного абсцесса, локализующегося в IV—VIII сегментах печени близко к диафрагмальной поверхности. Доступ выбирают в зависимости от места наибольшего предлежания абсцесса к нижним отделам грудной клетки. На установленном уровне рассекают кожу и мышцы и поднадкостнично резецируют ребро на протяжении 10—12 см. Если плевральный синус оказывается не вскрытым, его тупо отслаивают, оттесняют вверх и производят диафрагмо-томию. В тех случаях, когда плевральный синус вскрыт, рассекают диафрагму и центральный край ее подшивают отдельными швами к грудной стенке выше разреза последней.
Пальпаторно устанавливают место флюктуации печени и пунктируют его. При попадании иглы в абсцесс гной аспирируют, вблизи иглы на протяжении 4—6 см рассекают брюшину и тупо корнцангом или пальцем проникают в полость гнойника. После пальцевой ревизии полости и удаления из нее всех некротизиро-ванных тканей через образованный канал проводят два трубчатых дренажа, которые фиксируют отдельными швами к коже.
В послеоперационный период через дренажи в полость абсцесса вводят антибиотики, промывают ее растворами антисептиков, состав которых определяют в зависимости от типа возбудителей абсцесса.
Используя описанную технику дренирования, мы не наблюдали развития эмпиемы плевры ни у одного из 5 больных, у которых был вскрыт плевральный синус.
Дренирование плевральной полости дренажем по Бюлау в сочетании с дренажем абсцесса печени доступом с резекцией ребра рекомендуют выполнять при прорыве абсцесса в плевральную полость Р. П. Аскерханов и соавторы (1990).
Резекция печени с удалением абсцесса является оптимальным вариантом хирургического лечения, так как абсцесс удаляют в пределах здоровых тканей без вскрытия. Однако резекцию, чаще анатомическую, производят редко и в большинстве случаев как вынужденное мероприятие после безуспешности предыдущих этапов консервативного и хирургического лечения. Резекция печени обычно показана при наличии множественных абсцессов, расположенных в одной доле.
Характер операций, выполненных нами по поводу абсцессов печени за период с 1972 по 1985 г., и их результаты представлены в табл. 6.

Осложнения мы наблюдали у 19 больных: прогрессирование печеночной недостаточности — у 6, прогрессирование сепсиса — у 4, пневмонию — у 5, плеврит — у 3, наружный свищ — у 2, нагноение послеоперационной раны — у 8, острую язву желудка — у 1, кровотечение вследствие нарушения свертывания крови на фоне выраженной печеночной недостаточности — у 1. Сочетание нескольких осложнений имело место у 11 больных.
Разработка и внедрение в клиническую практику методов эхографии и компьютерной томографии знаменовали не только качественно новый уровень диагностики очаговых поражений печени, но и переход к новым нетрадиционным подходам к лечению абсцессов, включая их чрескожное дренирование и санацию.
Начиная с 1986 г. пункционная методика лечения абсцессов под контролем ультразвукового исследования и компьютерной томографии стала методом выбора и применена нами у 84 больных. Следует отметить, что у 85 % больных абсцессы печени развились после перенесенных операций на органах гепатопанкреатодуоде-нальной зоны.
Результаты лечения бактериальных абсцессов печени методом чрескожных пункций под визуальным контролем показали, что данный метод эффективен у больных с абсцессами пониженной акустической плотности, у которых на фоне лечения появляется грануляционный вал. Количество чрескожных пункций, помимо динамики клинико-лабораторных тестов, зависело от динамики изменений ультразвуковой структуры абсцесса. Для полной санации абсцессов большинству (80 % больных) потребовалось от 2 до 5 манипуляций; 20 больным полости были дренированы тонкими дренажами.
Начиная с 1986 г. к оперативному вскрытию абсцессов прибегаем только в тех случаях, когда диаметр гнойных полостей превышает 7 см, при наличии в полости детрита и секвестров, самопроизвольном вскрытии абсцесса в брюшную полость, кровотечении в полость абсцесса.
У 46 больных пункционная санация была неэффективной. Всем им произведено вскрытие и дренирование абсцессов. Умерли после санации 3 (6,5 %) больных.
Таким образом, наш опыт показывает, что пункционный метод санации и дренирования абсцессов, безусловно, более эффективный и экономически выгодный, чем оперативное вскрытие абсцессов.
Date: 2015-09-18; view: 958; Нарушение авторских прав