
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 2. ОПУХОЛИ ПЕЧЕНИ 3 page
|
|
Длительность возможного пережатия печеночно-дуоденальной связки без значительных нарушений функции печени до настоящего времени не определена. Мы пережимали связку на срок от 12 до 32 мин, не наблюдая осложнений в послеоперационный период.
О пережатии печеночно-дуоденальной связки во время резекции печени на срок 51, 55 и 60 мин без осложнений в послеоперационный период сообщают С. Huguet и соавторы (1978).
Экспериментальными исследованиями показано, что для предупреждения нарушений гемодинамики и метаболизма во время пережатия печеночно-дуоденальной связки показано переливание реополиглюкина, изотонического раствора натрия хлорида, 4 % раствора натрия гидрокарбоната в соотношении 1:3:1 (В. П. Сухоруков, 1982). Для подтверждения гемодинамики во время резекции печени автор рекомендует переливать кровь, коллоидные и кристаллоидные растворы в соотношениях 2:1:3 и 5:3: 12.
Необходимо учитывать, что после пережатия связки прекращается приток артериальной и венозной крови к печени, но не останавливается кровотечение, вызванное повреждением вен. Это объясняется возможным ретроградным поступлением крови в печень из печеночных вен. Для остановки венозного кровотечения прежде всего сдавливают соответствующую долю печени руками. Обычно это делает ассистент. Иногда таким образом удается уменьшить кровоточивость в операционной ране и выполнить необходимое вмешательство. Однако обычно полного гемостаза не достигают, и кровопотеря за время операции превышает 1000—1500 мл и более. Более надежным методом временного гемостаза является временное выключение печени из кровообращения.
Временное выключение печени из кровообращения. Показанием к применению этого метода служат: тесное соприкосновение опухоли с ветвью воротной вены вблизи развилки или прорастание опухоли в эту ветвь или в одну из печеночных вен, подозрение на прорастание опухоли в нижнюю полую вену. Необходимость временного выключения печени из кровообращения вызвана тем, что из-за опухоли не удается захватить в зажим один из концов вены.
Принцип метода заключается в том, чтобы прекратить поступление крови в печень по собственной печеночной артерии, воротной и печеночным венам. Однако поскольку сами по себе печеночные вены труднодоступны, то прибегают к прекращению кровотока на всем внутрипеченочном сегменте нижней полой вены. Прекращение кровотока по собственной печеночной артерии и воротной вене, как указывалось выше, достигается наложением турникета на печеночно-дуоденальную связку на срок до 32 мин, что требует специальной подготовки и применения каких-либо дополнительных мер.
Прекращение кровотока по внутрипеченочному сегменту нижней полой вены сопровождается резким сокращением притока крови к сердцу (на 50—60 %). В результате нарушается сердечная деятельность. Артериальное давление падает до 0 уже через 40 с. Для продления периода пережатия нижней полой вены используют различные методы.
Внутрисосудистое шунтирование заключается в том, что в просвет нижней полой вены вводят трубку диаметром 1—2 см. Для введения трубки используют либо разрез стенки вены на уровне почечных вен, либо (при торакоабдомипальном доступе) разрез ушка правого предсердия.
Доступ к надпеченочному сегменту нижней полой вены путем рассечения диафрагмы применяют у детей в возрасте 2—5 лет, когда основной этап операции выполняют через лапаротомный доступ. Непосредственно ниже и выше печени нижнюю полую вену перевязывают на трубке. При этом попадание крови в печеночные вены исключается, в то время как кровоток по нижней полой вене в сердце сохраняется. Экспериментальными исследованиями определены требования к трубке, используемой для внутрисосудистого шунтирования. Внутренний диаметр ее должен быть не менее половины диаметра нижней полой вены, а площадь отверстий, через которые происходит забор крови, в 3 раза больше площади сечения трубки (М. Germain и соавт., 1978).
А. М. Гранов и соавторы (1982) применяли для окклюзии нижней полой вены выше и ниже внутрипеченочного сегмента ее надувные баллоны. Через бедренную вену проводили трехканальный катетер. Два канала предназначались для раздувания баллона в под- и надпеченочном сегментах нижней полой вены. Через третий канал происходил отток крови из печени. Трехканальный катетер позволял проводить антеградную (через воротную вену) или ретроградную (через печеночные вены) перфузию печени на время выключения ее из кровообращения. Вводили перфузат температурой 18—20 °С со скоростью 100—150 мл/мим. В течение 5—7 мин печень охлаждалась до 27—28 °С, и на этом уровне температура ее стабилизировалась. Методика изолированной перфузии печени на 10—40 мин применена авторами у 8 больных, причем у 3 больных с метастатическим раком в состав перфузата включен фторурацил. Перфузию печени изотоническим раствором натрия хлорида или раствором Рингера температурой 4°С в течение 45—115 мин применили Salasson и соавторы (1979). Подключение аппарата искусственного кровообращения для обеспечения длительной перфузии печени разработали В. С. Шапкин и соавторы (1980). Существенным преимуществом перфузии является также возможность вымывания током жидкости опухолевых тромбов (J. G. Fortner и соавт., 1974).
Мы производили выключение печени из кровообращения по следующей методике. Через две периферические вены катетеризировали центральные вены и начинали инфузию 5 % и 20 % растворов глюкозы, полиглюкина или реополиглюкина и желатиноля с тем, чтобы поднять центральное венозное давление до 160— 180 мм вод. ст. Накладывали турникет на печеночно-дуоденальную связку, не пережимая ее. Мобилизовывали двенадцатиперстную кишку и головку поджелудочной железы по Кохеру. Непосредственно под ними выделяли нижнюю полую вену. Необходимо помнить о почечных и правой надпочечниковой венах, которые впадают в нижнюю полую вену на этом уровне. Выше почечных и правой надпочечниковой вен выделяли нижнюю полую вену по окружности и накладывали на нее турникет, не пережимая его. В поддиафрагмальном пространстве выделяли надпеченочный сегмент нижней полой вены по передней и боковым поверхностям. Мы стремились к выделению вены по всей окружности, так как это связано с опасностью повреждения нижних диафрагмальных вен, а также задней стенки нижней полой вены. Мобилизацию надпеченочного сегмента нижней полой вены считали достаточной, если удавалось пережать просвет ее наложением сердечного зажима. Бужировали пупочную вену и вводили в нее катетер диаметром до 3 мм, а при невозможности использования пупочной вены вводили катетер через правую желудочную артерию в собственную печеночную артерию.
Убедившись в достаточном наполнении сосудистого русла, повышении центрального венозного давления до 160—180 мм вод. ст. и наличии растворов для струйного вливания, затягивали турникеты на печеночно-дуоденальной связке и подпеченочном сегменте нижней полой вены и накладывали сердечный зажим на надпеченочный участок вены. Одновременно начинали струйное вливание 5 % и 20 % растворов глюкозы, изотонического раствора натрия хлорида, 4 % раствора натрия гидрокарбоната, полиглюкина и желатиноля через внутривенные катетеры.
Описанная техника позволяла полностью выключать печень из кровообращения на срок до 32 мин без резких колебаний центральной гемодинамики. Перед восстановлением кровотока вводили фуросемид в дозе до 120 мг для быстрого выведения излишка жидкости из организма, а также 4 % раствор натрия гидрокарбоната до 600—800 мл для коррекции ацидоза. Выключение печени из кровообращения позволило сократить кровопотерю даже при расширенной гемигепатэктомии до (780±80) мл.
После отсечения резецируемой части печени вместе с опухолью через катетер, установленный в пупочной вене (или правой желудочной артерии), промывали сосудистое русло печени, используя 800 мл изотонического раствора натрия хлорида. Затем сосуды по раневой поверхности печени перевязывали и восстанавливали кровоток в печени, последовательно снимая зажимы с надпочечного сегмента нижней полой вены, печеночно-дуоденальной связки подпеченочного сегмента нижней полой вены. По мере восстановления кровотока захватывали зажимами и перевязывали кровоточащие сосуды на раневой поверхности печени, не обнаруженные ранее. Установление дренажей, отграничение их от остальной брюшной полости проводили так, как это было описано ранее.
Безопасность нормотермического выключения печени из кровообращения на срок до 65 мин отметили С. Huguet и соавторы (1978). При длительности ишемии 34—65 мин температура печени к моменту возобновления кровотока снижалась до 33,5—30,9 °С. Помимо пережатия печеночно-дуоденальной связки и нижней полой вены под и над печенью авторы у 7 больных прибегли к пережатию аорты непосредственно ниже диафрагмы, что позволило снизить кровопотерю в среднем в 3 раза.
Искусственную гипотермию со снижением температуры в пищеводе до 31—33,5 °С применил во время пережатия печеночно-дуоденальной связки Г. И. Веронский (1978).
В качестве контроля состояния печени на время выключения ее из кровообращения предлагают определять рН на ее поверхности (А. С. Mac Donald и соавт., 1979). В эксперименте на собаках авторы установили строгую корреляцию изменений рН, содержания кислорода и молочной кислоты.
Искусственную гипотензию после введения арфонада применил во время резекции печени у 11 больных Г. И. Веронский (1978). Достоверного снижения кровопотери во время операции не отмечено, что, по мнению автора, связано с невозможностью поднять печень достаточно высоко для ее обескровливания.
Атипичную резекцию печени считаем показанной при метастатических опухолях, поражающих незначительную часть сегмента органа и расположенных вдали от крупных сосудов и желчных протоков. Плоскости рассечения паренхимы печени при атипичной резекции не совпадают с границами секторов и сегментов, однако особенности сегментарного строения необходимо обязательно учитывать во время операции, чтобы не образовались участки органа с нарушенным кровотоком или желчеоттоком.
Участки печени, на которых возможно выполнение атипичной резекции, показаны на рис. 17.
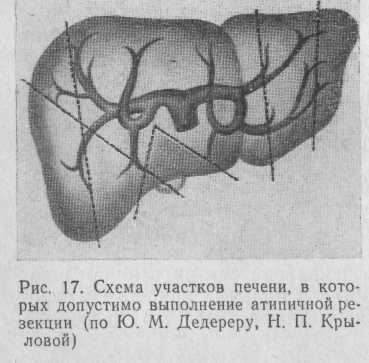
По линии предполагаемой резекции печень на всю толщину прошивают несколькими П-образными кетгутовыми швами, а затем клиновидно иссекают участок печени вместе с новообразованием. Если имеется истечение крови и желчи с раневой поверхности, необходимо дополнительно наложить П-образные швы через всю толщину печени.
Наружный дренаж желчных протоков после резекции печени применяют Н. Bahr и соавторы (1981). Они считают, что свободный отток желчи способствует более быстрому восстановлению нормальных показателей билирубина и трансаминаз в сыворотке крови.
Мы применили наружный дренаж желчных протоков после резекции печени по поводу опухоли у 3 больных. Какого-либо изменения течения послеоперационного периода у них по сравнению с теми, у которых такой дренаж не использовали, не наблюдали.
Обработку раневой поверхности печени клеем применяли в экспериментальных и клинических условиях А. И. Халькин (1970) и В. С. Готье (1976). Отмечено уменьшение частоты осложнений, связанных с просачиванием крови и желчи после резекции печени. Однако синтетический клей вызывает острую тканевую реакцию, что ограничивает его широкое применение.
Специальный клей в эксперименте применили J. Scheele и соавторы (1981). В один шприц набирали криопреципитированный фибриноген со средним содержанием протеина 90 мг/мл, а во второй — тромбин, соли кальция, фактор свертывания крови XIII и ингибитор фибринолиза апротинин. Оба компонента клея одновременно наносили на раневую поверхность печени, края раны осторожно прижимали один к другому. Склеивание наступало через 2—3 мин, остановка кровотечения — еще через 30—60 с.
Криовоздействие на печень в целях гемо- и холестаза в эксперименте изучали Б. П. Сандомирский и соавторы (1978), Ю. А. Мартынов и соавторы (1979), Л. М. Парамонова (1980). Установлено, что после криовоздеиствия наступает тромбоз мелких сосудов и окклюзия мелких желчных протоков, кроме того, отмечена ярко выраженная стимуляция регенераторных процессов в близлежащей паренхиме печени.
Нами изучено в эксперименте и применено у 4 больных криовоздействие на паренхиму печени после ее резекции с помощью отечественной установки «Криоэлектроника». Отмечено, что уже при охлаждении до —20 °С прекращается просачивание крови и желчи с раневой поверхности. Однако независимо от продолжительности охлаждения через 5—20 мин после оттаивания кровотечение возобновилось, но было менее интенсивным. Повторное криовоздействие еще более уменьшило отделение крови и желчи, но полностью оно не прекращалось. Наш опыт позволяет сделать заключение, что криовоздействие в целях гемостаза после резекции целесообразно использовать только при дряблой паренхиме, когда наложение швов через всю ткань печени невозможно из-за их прорезывания, а крупные сосуды и желчные протоки в плоскости резекции перевязаны изолированно.
Прошивание печени через прокладки — фасцию, большой сальник, синтетические ткани — широко изучалось в предшествующие годы. Однако в настоящее время в связи с рассечением печени по междолевым и межсегментарным щелям необходимости в сдав-лении паренхимы для гемостаза и остановки желчеистечения нет. Более того, как указывалось выше, прошивание печени через всю толщину ее чревато ишемией и некрозом паренхимы.
Для типичных резекций в последние годы применяем разработанный нами способ рассечения паренхимы печени с помощью механического шва аппаратом УК.Л. При этом предварительную обработку элементов портальных и кавальных ворот не производим.
После мобилизации правой доли печени скальпелем рассекаем фиброзную оболочку вдоль намеченной линии резекции строго в проекции междолевой борозды по верхней и нижней поверхности печени. Дигитоклазией тупо проводим палец над глиссоновой триадой в нижней части печени по срединной спайке, отодвигая кпереди печеночные вены, выводим палец на переднюю поверхность печени с учетом возможности захвата паренхимы печени аппаратом УКЛ. После прошивания паренхимы печени отсекаем ткань по краю УКЛ со стороны удаляемой части печени. При появлении кровотечения сосуды пережимаем зажимами. Затем выделяем печеночную вену (правую — при удалении правой половины, левую — при удалении левой половины) так, чтобы палец проник между ней и полой веной по направлению к частично рассеченной спайке над глиссоновой триадой, в это отверстие вводим УКЛ и прошиваем. Отсекаем ткань печени вместе с веной со стороны удаляемой ткани печени. При отсечении удаляемой ткани пальцами сдавливаем ткань с сосудами, а затем прошиваем. Наконец, палец проводим по боковой поверхности полой вены, захватывая оставшуюся часть удаляемой ткани, и по ходу ее проводим УКЛ, беря в захват глиссонову триаду удаляемой части печени до развилки, прошиваем и отсекаем. На оставшейся поверхности печени с помощью добавочных швов и коагуляции останавливаем кровотечение. К ране подводим дренаж.
Прошивание печени аппаратом УКЛ, кроме этого, применяют при атипичной краевой резекции, выполняемой на фоне цирроза или резкого истончения паренхимы печени. Для удаления II и III сегментов печени или выполнения левосторонней гемигепатэктомии с помощью аппарата УКЛ требуется предварительное рассечение покрывающей печень брюшины и некоторое расслоение паренхимы. Использование аппарата УКЛ у 42 больных показало его достаточную эффективность.
У 20 больных рассечение паренхимы печени мы производили ультразвуковым аспиратором SUS-201Д-Aloka (Япония). Для этого после надсечения скальпелем фиброзной оболочки вдоль намеченной линии резекции методически разрушали и аспирировали только ткань паренхимы. Таким образом, в ране отчетливо визуализировались все сосудисто-секреторные элементы — как магистральные, так и соединяющие поверхности оставляемой и резецируемой частей печени. Коммуникантные структуры поэтапно лигировали на зажимах, что обеспечивало практически бескровное операционное поле. Следует отметить, что ультразвуковой аспиратор позволяет также своевременно верифицировать аномалии интраорганных структур, предупреждая опасные последствия нарушения их целости. Работа с ультразвуковым аспиратором требует терпения и выдержки. Опыт показывает, что удлинение при этом времени операции оправдывает риск грозных осложнений, возможных при использовании более «скорых» методов в технически сложных ситуациях. Показанием к применению ультразвукового аспиратора чаще всего служила локализация очага поражения в близи крупных сосудов и желчных протоков в паренхиме печени с угрозой их повреждения и возникновения массивного кровотечения.
Резекцию печени с использованием лазерного скальпеля выполнили 10 больным. При этом достигали тщательного коагуляционного гемостаза раневой поверхности печени. Применение лазерной установки «Ромашка-2» позволило нам во всех случаях добиться надежного окончательного гемостаза после резекции печени фиссуральпым способом. У 5 больных во время операции сочетали уль тразвуковой аспиратор с лазерным скальпелем.
Коагуляцию раневой поверхности инфракрасными лучами с успехом применили при 158 резекциях печени Е. Guthy и соавторы (1984).
Мы оперировали 257 больных с опухолями печени различного характера. Злокачественное поражение отмечено у 220 (85,5%) больных. У 112 больных был первичный рак печени, у 108 — метастатический. Возраст больных составил 5—75 лет. Мужчин было большинство (62 %). Радикальные операции удалось выполнить 88 (40 %) больным. Характер операций и их непосредственные результаты представлены в табл. 1

Из 13 больных с метастатическими опухолями печени одновременно выполнены вмешательства, связанные с удалением первичной опухоли желудка, у 8, ободочной кишки — у 5.
Послеоперационная летальность. По данным М. Balasegavan и S. К. Joishy (1981), летальность после резекции печени по поводу первичного рака составила 14,1 %, по поводу метастатического рака— 20 %, по поводу непосредственного прорастания опухоли в печень — 4,1 % (133 больных). Однако другие авторы указывают на более низкую летальность после резекции печени по поводу метастатических опухолей — 1,7—8 % (F. Ghussen и соавт., 1985). Из оперированных нами 37 больных со злокачественными новообразованиями печени после резекции умерли 5.
Применение перечисленных выше методов пережатия печеночно-дуоденальной связки и временное выключение печени из кровообращения во время плановых резекций печени позволило свести к нулю летальные исходы, обусловленные массивным кровотечением из поврежденных крупных сосудов. Среди причин смерти основное значение имеют осложнения, связанные с неправильным выбором объема оперативного вмешательства и недостаточно тщательной техникой оперирования.
Осложнения резекции печени. Внутрибрюшное кровотечение и фибринолиз взаимосвязаны. Массивная кровопотеря может быть обусловлена повреждением воротной вены и ее ветвей или печеночных вен и нижней полой вены в результате недостаточно тщательного соблюдения техники операции или отказа от использования временного выключения печени из кровообращения в тех случаях, когда оно необходимо. Обильной кровопотере способствует также нарушение свертывания крови у больных с сопутствующим циррозом печени.
Первым признаком наступающего фибринолиза является отсутствие сгустков в излившейся крови. При подозрении на фибринолиз необходимо хотя бы временно остановить кровотечение и восполнить кровопотерю, а уже после этого продолжать операцию.
В послеоперационный период источником внутрибрюшного кровотечения являются мелкие сосуды раневой поверхности печени, не перевязанные во время операции. Такое осложнение развивается при поспешном окончании операции в случае невысокого артериального давления. Выявление же внутрибрюшного кровотечения в послеоперационный период требует немедленной релапаротомии и прошивания кровоточащих сосудов.
Печеночная недостаточность является следствием неполного обеспечения потребностей организма оставшейся паренхимой печени. Наш опыт и наблюдения других хирургов свидетельствуют о том, что при неизмененной паренхиме печени резекция до 80 % объема органа безопасна и хорошо переносится больными. Однако у больных циррозом печени выбор объема резекции требует индивидуального подхода.
Н. Bahr и соавторы (1981) предлагают использовать визуально оцениваемую гипертрофию непораженной доли печени как показатель прогноза функции печени в послеоперационный период. По наблюдениям авторов, больные, у которых не было гипертрофии непораженной части печени, умерли после операции от прогрессирующей печеночной недостаточности.
Более точный метод прогнозирования функции печени после ее резекции разработали Т. Takasaki и соавторы (1980). Они внутривенно вводили индоциан зеленый в дозе 0,5 мг/кг. Из вены другой руки производили забор крови через 5, 10, 15 мин, колориметрически определяли концентрацию красителя в крови и наносили ее на график на полулогарифмической шкале. Определяли скорость очищения крови от красителя (К).
Проведенные авторами расчеты показывают, что при отсутствии цирроза печени К равен 0,2 мг/(кг-мин). Безопасной является резекция до 80 % объема паренхимы печени. Снижение К до 0,12 мг/(кг-мин) ограничивает безопасный объем резекции до 50%, при снижении К до 0,06 мг/(кг-мин) безопасна резекция не более 10 % объема печени.
Э. И. Гальперин и соавторы (1988) указывают, что печеночная недостаточность занимает 3-е место в структуре послеоперационных осложнений резекций печени. Исходя из этого, авторы придают большое значение оценке морфологического состояния остающейся части печени путем прицельной аспирационной биопсии тонкой иглой под контролем ультразвукового исследования или компьютерной томографии.
В комплексном лечении печеночной недостаточности в клинике Шарите в последние годы применяют аминокислотный препарат для внутривенного введения comafusion Hepar. Продукция белков в пораженной печени после применения указанного препарата возрастает более чем в 4 раза.
Печеночную недостаточность мы наблюдали в послеоперационный период у 12 больных, которым была произведена резекция печени по поводу опухоли. Прогрессирующая печеночная недостаточность явилась причиной смерти 4 больных.
Некроз и секвестрация паренхимы печени возникают вследствие нарушения кровоснабжения участка печени после ее резекции без учета сегментарного строения. Мы наблюдали подобное осложнение у 2 больных, оперированных в других лечебных учреждениях. В тех случаях, когда зона некроза находится вблизи края печени, через 8—12 сут после операции на фоне гектической температуры тела появляется гнойное отделяемое из дренажа, иногда с примесью желчи. Еще через 10 сут, а иногда в более поздние сроки происходит отхождение секвестров некротизированных тканей.
Однако если участок некроза расположен в глубине печени, в послеоперационный период формируется абсцесс печени с типичной клинической картиной.
Если нет типичного отделяемого через дренажи, установленные вблизи плоскости резекции печени, температура тела ежедневно в течение 10—14 сут повышается до 38 °С и больше при отсутствии других причин гипертермии (пневмонии, флебита), следует предположить некроз печени с образованием абсцесса и предпринять релапаротомию.
Тромбоз воротной вены и ее ветвей. Способствующими факторами считают замедление тока крови и сгущение ее. Это осложнение мы наблюдали у 1 больного (летальный исход).
Клиническая картина осложнения характеризуется сильной постоянной болью в верхней половине живота, вздутием живота, замедлением перистальтики, появлением асцита. Через 1—2 сут прогрессируют признаки печеночной недостаточности.
Лечение тромбоза воротной вены заключается в восполнении объема циркулирующей крови, введении гепарина по 5000— 10 000 ЕД для увеличения времени свертывания крови до 10— 12 мин. Одновременно применяют и другие меры для профилактики и лечения печеночной недостаточности (см. главу «Непроходимость желчных протоков доброкачественной этиологии»).
Поддиафрагмальный абсцесс возникает вследствие неадекватного дренирования брюшной полости вблизи раневой поверхности печени. Большое значение имеет правильное расположение дренажей после гемигепатэктомии и расширенной гемигепатэктомии. В послеоперационный период необходимо промывать каждый дренаж 3—4 раза в сутки, используя 20—30 мл раствора фурацилина 1:5000 или 0,02 % раствора хлоргексина, добиваясь сообщения дренажей между собой.
Второй важной мерой профилактики поддиафрагмального абсцесса является тщательная обработка раневой поверхности печени после резекции. Изолированное лигирование каждого сосуда и желчного протока в плоскости разреза предотвращает образование большого количества раневого отделяемого.
В послеоперационный период необходим дифференцированный подход к оценке отделяемого через дренажи. При возникновении печеночной недостаточности, особенно у больных с сопутствующим циррозом печени, через дренажи выделяется большое количество асцитической жидкости. Длительное удержание дренажа в этих условиях может привести к вторичному инфицированию поддиафрагмального пространства. Поэтому при отсутствии в отделяемом примеси крови и желчи и температуре тела выше 38 °С дренажи удаляем на 4—6-е сутки после операции.
Формирование поддиафрагмального абсцесса сопровождается лихорадкой септического типа. При обзорном рентгенологическом исследовании органов грудной и брюшной полостей выявляется ограничение подвижности купола диафрагмы и признаки реактивного плеврита. Иногда обнаруживается полость с уровнем жидкости и скоплением газа над ней. Э. И. Гальперин и соавторы (1988, 1990) важную роль в диагностике послеоперационных гнойников брюшной полости отводят динамическому ультразвуковому контролю. При обоснованных подозрениях на формирование околопеченочных гнойников с последующей секвестрацией нежизнеспособных тканей ультразвуковые исследования дополняются санирующей чрескожной пункцией, очень часто многократной.
Если прямых признаков абсцесса нет, в течение 10—14 сут отмечается повышение температуры тела до 38 °С и более и нет других очагов воспаления (пневмония, флебит), то показаны релапаротомия и ревизия поддиафрагмального пространства и культи печени.
При обнаружении абсцесса его необходимо дренировать. Для доступа к полости абсцесса после левосторонней гемигепатэктомии, как правило, достаточно развести операционный разрез у верхней его части. Правосторонний поддиафрагмальный абсцесс опорожняют и дренируют из доступа по Мельникову — через ложе XII ребра сзади или через ложе VIII ребра спереди. Разрезом длиной 8—10 см рассекают кожу, фасции и мышцы по ходу ребра. Рассекают и отслаивают надкостницу ребра. Поднадкостнично резецируют ребро. Тупо отслаивают брюшину вниз, определяя место флюктуации над абсцессом. Здесь пунктируют через брюшину полость абсцесса и отсасывают его содержимое. Затем по игле широко вскрывают абсцесс и дренируют полость его 3— 4 перчаточно-трубчатыми дренажами, которые фиксируют отдельными швами к коже.
Околопеченочные абсцессы развились у 9 из 88 больных, у которых резекция была выполнена по поводу опухоли печени. После дренирования абсцесса все больные выздоровели.
Желчный свищ возникает при недостаточно тщательной обработке раневой поверхности печени после резекции. Если остаточная полость хорошо дренируется, то желчный свищ не представляет опасности для жизни больного. При недостаточном дренировании на месте выделения и скопления желчи формируется абсцесс.
Желчные свищи после резекции печени образовались у 3 наблюдаемых нами больных, свищи закрылись самостоятельно.
Другие осложнения резекций печени возникают и после других операций, связанных с вмешательством на органах брюшной полости. Так, тромбоэмболия легочной артерии была причиной смерти у 1 больного, оперированного по поводу первичного рака печени.
Средняя продолжительность жизни радикально оперированных больных с первичными злокачественными новообразованиями печени составляет 18,7—26,7 мес (Н. Н. Блохин и соавт., 1981; R. С. Lim, F. S. Bongard, 1983).
Для дифференцированного учета отдаленных результатов резекции печени с удалением опухоли I. Iegin и соавторы (1980) ввели понятие «опухоли малых размеров». Малой опухолью они считают единичное новообразование диаметром не более 5 см или две опухоли общим объемом не более 125 см3. Авторы указывают, что после анатомических сегмент- и лобэктомий, выполненных у 22 больных с малыми размерами гепатоцеллюлярного рака, трехлетняя выживаемость составила 70,5 %.
По данным В. Д. Федорова и соавторов (1980), средняя продолжительность жизни 12 больных, которым производили резекцию печени с удалением метастаза и радикальное удаление первичной опухоли прямой кишки, составила 3 года.
Полученные результаты свидетельствуют о целесообразности удаления одного или нескольких метастазов рака толстой кишки в печени, если они обнаруживаются во время первичного вмешательства или после него, а других признаков генерализации опухолевого процесса нет.
Деартериализация печени как метод лечения основана на том, что злокачественные новообразования печени питаются преимущественно артериальной кровью (С. Breedis, I. Loug, 1954). Поэтому прекращение артериального кровотока должно приводить к некрозу опухоли. В то же время известно, что печеночная артерия доставляет только 25 % объема крови, поступающего в печень (W. J. Schenk и соавт., 1962), и в большинстве случаев прекращение артериального кровотока не создает угрозы некроза паренхимы печени.
Date: 2015-09-18; view: 561; Нарушение авторских прав