
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Результати оформлення роботи
|
|
Всі записи, що будуть зроблені на дошці студентами при вивченні даної теми, оформляються у вигляді звіту в лабораторному зошиті.
КОНТРОЛЬНІ ПИТАННЯ
1. Від чого залежить геометрична конфігурація молекул? Приведіть приклади.
____________________________________________________________________________________________________________________________________________
2. Вкажіть на основні особливості водневого зв’язку, який вплив на хімічні та фізичні властивості речовин має цей зв’язок?
____________________________________________________________________________________________________________________________________________
3. Який зв’язок називається іонним? Чи досягають ефективні заряди однозарядних іонів одиниці?
____________________________________________________________________________________________________________________________________________
4. Чи завжди співпадають поняття “окислювальне число” і “заряд іона”? Приведіть приклади.
____________________________________________________________________________________________________________________________________________
5. Користуючись таблицею відносних електронегативностей, обчислити їх різницю для зв’язків K – Cl, Ca – Cl, Fe – Cl, Ge – Cl. Який зі зв’язків характеризується найбільшою іонністю?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6. Вказати характер зв’язку в молекулах NCl3, CS2, ICl5, OF2, ClF, CO2? Вказати для кожної з них до якого атому зміщена загальна електронна пара.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
7. Вкажіть тип гібридизації атомних орбіталей Силіцію в молекулах SiH4 та SiF4. Чи полярні дані молекули?
____________________________________________________________________________________________________________________________________________
ТЕМА: хімічна термодинаміка та напрямок хімічних реакцій
Галузь термодинаміки, що вивчає енергетичні зміни в хімічних реакціях, називається хімічною термодинамікою.
При протіканні хімічних процесів мають місце глибокі якісні зміни в системі: рвуться хімічні зв’язки в вихідних речовинах, утворюються нові зв’язки в молекулах продуктів. Ці зміни супроводжуються поглинанням і виділенням енергії. В більшості випадків це теплова енергія.
Розділ термодинаміки, що вивчає теплові ефекти хімічних реакцій, називається термохімією.
Процеси, що відбуваються при постійному тиску, називають ізобарними, а при постійному об’ємі – ізохорними.
Термодинаміка розглядає загальні закономірності протікання хімічних реакцій. Кількісно вони можуть бути визначені такими термодинамічними характеристиками (термодинамічними функціями): внутрішня енергія системи (U), ентальпія (Н), ентропія (S) і ізобарний потенціал (вільна енергія Гібса – G).
Внутрішня енергія речовини U – це сукупність всіх видів енергії частинок, що складають дану систему.
Відповідно до першого началу термодинаміки зміна внутрішньої системи визначається рівнянням:
ΔU = Q – A (1)
де: ΔU – зміна внутрішньої енергії системи;
Q – теплота, що поглинається (або виділяється системою);
А – робота, що виконується системою.
Хімічні реакції у більшості випадків протікають при постійному тиску (р = const). В цьому випадку зручно використовувати поняття ентальпія. В загальному вигляді її можна записати як:
Н = V + pV (2).
За умов, що термодинамічна система виконує роботу розширення, зміна ентальпії може бути записана як:
ΔH = ΔU + pΔV = ΔU + A (3),
де, pΔV – робота розширення даної системи (pΔV = А).
Порівнюючи рівняння (1) і (3) отримуємо:
ΔH = Qp, (4)
Де Qp – теплота, що поглинається системою при постійному тиску (на це вказує індекс р біля Q).
З точки зору термохімії теплота, що поглинається системою, відповідає ендотермічній реакції з тепловим ефектом – Q.
Звідси витікає важливий висновок: зміна ентальпії в хімічній реакції, що протікає при постійному тиску і температурі, дорівнює тепловому ефекту реакції, взятий з протилежним знаком. Тобто, для ендотермічних процесів ΔH > 0; для екзотермічних процесів ΔH < 0.
При розрахунках ентальпії реакцій можна застосувати два способи запису:
1. В термодинаміці, теплота, що виділяється системою, позначається знаком (-), що означає втрату енергії; теплота, що поглинається при реакції, позначається знаком (+): це означає зростання енергії системи.
Наприклад: С(т) + О2 (г) = СО2 (г) ΔH0 = - 393,81 кдж/моль
(реакція екзотермічна)
2С(т) + Н2 (г) = С2Н2 (г) ΔH0 = +226,75 кдж/моль
(реакція ендотермічна).
2. В термохімічних записах, теплота, що виділяється в реакції позначається знаком (+), а та, що поглинається – знаком (-).
Наприклад: С(т) + О2 (г) = СО2 (г) + 393,81 кдж/моль
(реакція екзотермічна)
2С(т) + Н2 (г) = С2Н2 (г) - 226,75 кдж/моль
(реакція ендотермічна).
В термічних рівняннях вказують модифікацію і фазовий стан реагуючих речовин: к – кристалічна; р – рідкий; г – газ; т – тверда; або С(ГРАФІТ), С (АЛМАЗ).
Всі термохімічні розрахунки роблять на основі законів:
1. Закон Лавуаз’є – Лапласа: теплота розкладу хімічної сполуки дорівнює теплоті її утворення, взята з протилежним знаком.
Наприклад: Н2О (Р) = Н2 (Г) + ½ О2 (Г) ΔН = + 285,84 кдж/моль
Н2 (Г) + ½ О2 (Г) = Н2О (Р) ΔН = - 285,84 кдж/моль
Отож, при розкладанні складної речовини на прості виділяється (або поглинається) стільки ж тепла, скільки поглиналося (або виділялося) при його утворенні з простих речовин.
Теплотою утворення (ентальпією утворення) даної сполуки називають тепловий ефект реакції утворення цієї сполуки з простих речовин, що взяті в найпоширенішому в стандартних умовах стані.
2. Закон Гесса: при постійній температурі та об’ємі тепловий ефект хімічного процесу не залежить від кількості його стадій, а визначається тільки початковим і кінцевим станами системи.
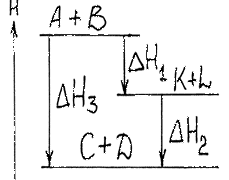
При термохімічних розрахунках часто користуються наслідком з закону Гесса:
“Тепловий ефект реакції (ΔQ х.р.) дорівнює сумі теплот утворення (ΔQ утв.) продуктів реакції мінус сума теплот утворення вхідних речовин” (з врахуванням коефіцієнтів перед формулами цих речовин в рівнянні реакції).
ΔQ х.р. = Σ ΔQ утворених продуктів – Σ ΔQ утворення вихідних речовин (5)
На основі закону Гесса та його наслідку можна розрахувати теплові ефекти багатьох реакцій, використовуючи дані теплових ефектів інших реакцій, які або більш доступні для точного вимірювання або в літературі є для них дані.
Слід звернути увагу й на те, що в термохімічних таблицях теплоти утворення простих речовин дорівнюють нулю. Треба відрізняти також теплоту утворення, тому що вона вища за молекулярну.
Фактори, що визначають напрямок хімічних реакцій.
У природі існує багато екзотермічних процесів: згорання палива, реакція нейтралізації, процеси кристалізації, біохімічні процеси тощо. Звідси виник принцип Бертло–Томсена, відповідно до якого самодовільно (спонтанно) протікають тільки ті процеси, при яких ентальпія системи зменшується.
Але відомо також багато спонтанних процесів: випарювання рідин, розчинність у воді таких речовин як KCl, KNO3, розширення газів, то що. Тому екзотермічність процесу не може бути єдиним фактором, що визначає можливість його протікання: це залежить також від стану внутрішньої структури системи. В самій природі речовини внаслідок руху її електронів, атомних ядер атомів, молекул закладено прагнення до переходу із стану з більшим впорядкуванням до менш впорядкованого стану. Так, при розчиненні твердої речовини відбувається спонтанний перехід від більш впорядкованого стану кристалічної гратки до менш упорядкованого рідкого стану; випаровування рідин теж супроводжується зменшенням упорядкування часток у системі.
Мірою хаосу, невпорядкованості системи є ентропія (S). Вона відображає стан внутрішньої структури речовини у зв’язку з тепловим рухом її часток. Ентропія зростає із збільшенням рухливості часток при нагріванні, випаровуванні, плавленні, розчиненні, розширенні газу, при послабленні або розриві хімічних зв’язків між атомами тощо.
Процеси, що пов’язані з упорядкуванням системи: конденсація, кристалізація, стиснення, зміцнення зв’язків, полімерізація тощо – приводять до зменшення ентропії.
Ентропія – це статистичне поняття і має одиниці розміру енергетичні – Дж/(моль·К) або в ентропійних одиницях (е.о.): 1е.о.= 1 Дж/(моль·К). Ентропію, що визначена для стандартних умов (температура 298К; р = 101,33 кПа) позначають S0298, або S0; називають стандартною ентропією. У відповідності із наслідком із закону Гесса зміну ентропії (ΔS) можна підрахувати за рівнянням:
ΔSХ.Р. = 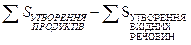 (6)
(6)
Отож на напрямок протікання процесу (в тому числі і хімічного) впливають дві протилежні тенденції, що закладені природою: з одного боку, частинки прямують до упорядкування (що веде до зменшення внутрішньої енергії і ентальпії системи); з другого боку – прямують до більш імовірного, максимально хаотичного стану, тобто до збільшення ентропії. Сумарний ефект цих двох протилежних тенденцій відбивається в термодинамічній функції, що називається ізобарно – ізотермічним потенціалом (або вільною енергією Гібса): позначається ΔG0298 або ΔG0; її розмірність: Дж/моль. Для простих речовин ΔG0 утворення умовно взята за нуль (як і ΔН0).
Взаємозв’язок між вільною енергією Гібса, ентальпією і ентропією системи відбивається у рівнянні:
ΔG = ΔН - Т ΔS = - А MAX (7)
де: ΔG – зміна ізобарного потенціалу системи під час процесу;
ΔН – зміна ентальпії;
ΔS – зміна ентропії;
Т – температура за шкалою Кельвіна;
А MAX – максимальна робота системи під час процесу.
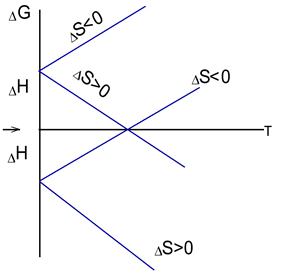 Дане рівняння є найважливішим в хімічній термодинаміці. З нього визначається з яких причин імовірна дана реакція: в одних випадках процесу сприяють і тепловий ефект і зміна ентропії, в других – процес йде завдяки екзотермічності реакції, в третіх – реакція можлива завдяки збільшенню ентропії. У всіх випадках, коли процес має місце, ΔG<0. Якщо ΔS>0, то реакції сприяють великі температури; в протилежному випадку (ΔS<0) імовірність реакції зростає при зниженні температури. Якщо ΔG>0, то реакція у даних умовах неможлива.
Дане рівняння є найважливішим в хімічній термодинаміці. З нього визначається з яких причин імовірна дана реакція: в одних випадках процесу сприяють і тепловий ефект і зміна ентропії, в других – процес йде завдяки екзотермічності реакції, в третіх – реакція можлива завдяки збільшенню ентропії. У всіх випадках, коли процес має місце, ΔG<0. Якщо ΔS>0, то реакції сприяють великі температури; в протилежному випадку (ΔS<0) імовірність реакції зростає при зниженні температури. Якщо ΔG>0, то реакція у даних умовах неможлива.
Розрахувати значення ΔG можна як з рівняння (7) так і з наслідку з закону Гесса:
ΔGХ.Р. =  (8)
(8)
Відповідні ΔG утворення речовин беруть з довідників.
У випадку, коли ΔG = 0 (це означає, що в рівнянні (7) ׀ΔН׀ =׀Т ΔS׀) система знаходиться у стані термодинамічної рівноваги. Такий стан спостерігається у фазових переходах (при плавленні, кристалізації, випаровуванні, конденсації тощо). З рівняння (7) маємо:
ΔG = ΔН - Т ΔS = 0;
ΔН = Т ΔS (9)
ΔS =  (10)
(10)
Застосовуючи рівняння (10) до фазових перетворень маємо:
ΔS  =
= 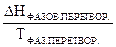 (11)
(11)
З рівняння (11) видно, що зміну ентропії в умовах фазових перетворень можна підрахувати, якщо визначити теплоту і температуру цих процесів.
Отже розрахунки термодинамічних характеристик системи ΔН, ΔS, ΔG дають можливість визначити імовірність протікання хімічної реакції і вплив на неї температури. Всі означені характеристики є функціями стану системи, тобто не залежать від кількості стадій в даному процесі, а визначаються тільки початковим і кінцевим станом речовин. Тому для їх розрахунків застосовуються однакові за формою рівняння (5), (6), (8).
Date: 2015-09-02; view: 539; Нарушение авторских прав