
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 6
|
|
Кінетика хімічних реакцій.
Мета роботи. встановити залежність швидкості реакції від природи і концентрацій реагуючих речовин, температури, ступеню здрібнювання твердих речовин, наявності каталізатора.
Прилади та реактиви: водяна мікролазня, штатив з кільцем і азбестовою сіткою, газовий пальник, термометр на 100 ºС, секундомір, бюретки. Гранульовані цинк і олово, карбонат кальцію (крейда) у шматочках. Розчини: розведеної та концентрованої хлороводневої кислоти, сірчаної кислоти (2н.), тіосульфату натрію Na2S2O3 (0,25н., та 0,1н.). Дистильована вода.
Дослід 1. Вплив природи реагуючих речовин на швидкість реакції
В дві пробірки налити по 1 мл розчину хлороводневої кислоти. До однієї з них опустити шматочок гранульованого стануму, до іншої — такий же за розміром шматочок цинку. Порівняти інтенсивність виділення пухирців газу.
Завдання. Скласти рівняння взаємодії хлороводневої кислоти з цинком і оловом. Зробити висновок про вплив природи реагуючих речовин на швидкість реакції.
Дослід. 2. Вплив ступеня здрібнювання на швидкість реакції
Взяти два маленьких шматочки крейди приблизно однакового розміру. Один зі шматочків помістити в пробірку, а інший подрібнити скляною паличкою на листку фільтрувального паперу, і порошок перенести в іншу пробірку. В обидві пробірки внести одночасно по 1 мл хлороводневої кислоти. Порівняти час розчинення крейди в кожному випадку.
Завдання. Скласти рівняння реакції між карбонатом кальцію і хлороводневою кислотою. Зробити висновок про вплив ступеня здрібнювання твердих речовин на швидкість реакцій.
Дослід. 3. Залежність швидкості реакції від концентрації реагуючих речовин
В три пробірки налийте по 5мл 2н розчину H2SO4.
В три стаканчика налийте: в перший 15мл тіосульфату натрію (Na2S2O3), в другий 10мл Na2S2O3 і 5мл Н2О, в третій 5мл Na2S2O3 і 10мл Н2О. Потім по черзі в кожний стаканчик вилийте 5мл H2SO4 з пробірки, включіть секундомір і швидко перемішайте. Спостерігайте час появи легкої опалесценції і подальшого помутніння розчину від осадженої вільної сірки в кожному стаканчику. Реакція тіосульфату натрію з сірчаною кислотою йде по рівнянню:
Na2S2O3 + H2SO4= Na2SO4 + S +SO2 +H2O
Результати спостереження записати у таблицю №1.
Таблиця №1
| № стаканчика | Розчин H2SO4, (мл) | Розчин Na2S2O3, (мл) | H2O, (мл) | Відносна концентрація Na2S2O3 | Час до появи помутніння розчину τ, с | Відносна швидкість реакції u=1/t, (с-1) |
Зробіть висновок про зміну швидкості реакції при зміні концентрації і накресліть графік у координатах u = f (С(Na2 S2 O2)), де на осі абсцис відкласти умовну концентрацію розчину тіосульфату натрію, на осі ординат — умовну швидкість реакції.
Завдання. Проаналізувати графік і зробити висновок про залежності швидкості реакції від концентрації реагуючих речовин.
Дослід 4. Залежність швидкості реакції від температури
Налийте в одну пробірку 5 мл розчину Na2S2O3, в другу – 5 мл розчину 2н Н2SO4. Обидві пробирки поставьте у стакан з водою і через 5-7 хвилин вимірте температуру води. Потім злийте разом розчини двох пробірок і спостерігайте, за який час з’явиться помутніння. У дві другі пробірки налити по 5 мл тих самих розчинів. Помістить пробірки в стакан з водою, нагрійте на 100 вище, ніж в попередньому досліді. Злийте розчини і спостерігайте за який час з’явиться помутніння. Повторіть дослід, підняв температуру ще на 100.
Результати досліду запишіть у таблицю №2.
Таблиця № 2
| № досліду | Температура досліду, t0 C | Час до появи помутніння t, с | Відносна швидкість реакції, u=1/t, (с-1) |
Накресліть графік у координатах V =f (t0), де на осі абсцис відкласти температуру, а на осі ординат — умовні значення швидкості реакції.
Завдання. Проаналізувати графік і зробити висновок про залежності швидкості реакції від температури.
Дослід № 5. Каталітичне відновлення манганцевокислого калію.
У колбу налити 15 мл 2н розчину сірчаної кислоти і 0,5 мл розчину КМnO4. Після перемішування розчин порівну розлити в три пробірки. В першу – додайте 0,5 мл 1н розчину KNO3 і покладіть гранулу цинку. В другу – покладіть тільки гранулу цинку, а третю залиште для порівняння.
Спостерігайте, в якій пробірці розчин манганцевокислого калію швидше знебарвлюється.
Завдання. Запишіть рівняння реакції у відсутності каталізатора, а також рівняння каталітичної реакції з утворенням проміжної сполуки KNO2.
Дослід № 6. Вплив зміни концентрації реагуючих речовин на рівновагу хімічної реакції.
У чотири пробірки внести по 5-7 краплин розведеного 0,0025н. розчину хлориду феруму (ІІІ) FeCl3 і роданіду калію KSCN. Одну з пробірок з отриманим розчином зберігайте для порівняння результатів досліду (еталон). В решту пробірок додати такі реактиви: в першу – 1 краплю насиченого розчину KSCN, в другу – 1 краплю насиченого розчину FeCl3, в треттю – декілька кристалів КСІ. Порівняти інтенсивність кольору отриманих розчинів з інтенсивністю кольору еталону.
Завдання. Скласти рівняння відповідної оберненої реакції і написати вираз для константи рівноваги. Як змінюється інтенсивність забарвлення розчину і в якому напрямку зрушується рівновага системи при додаванні розчинів FeCl3, KSCN і кристалів КСІ.
КОНТРОЛЬНІ ПИТАННЯ.
1. Вивченням яких питань займається хімічна кінетика?
2. Як можна виразити швидкість гомогенної та гетерогенної хімічної реакції?
3. В яких одиницях вимірюють швидкість хімічних реакцій?
4. Які фактори впливають на швидкість хімічних реакції?
5. Сформулюйте закон діючих мас.
6. Напишіть математичний вираз закону діючих мас для реакцій:
2СО + О2 =2СО2
N2 + 3H2 = 2NH3
7. Як читається закон Вант-Гоффа? Напишіть математичний вираз закону Вант-Гоффа.
8. Теорія активації. Як можна підвищити реакційну здатність молекул?
9. Що таке гомогенний, гетерогенний та мікрогетерогенний біокаталіз?
10. Що таке каталізатори та інгібітори?
11. Найважливіші фотохімічні реакції.
12. Що характеризує константа швидкості хімічної реакції і константа рівноваги?
13. Сформулюйте принцип Ле-Шател’є, якому підкоряється зрушування хімічної рівноваги. Як на практиці можна довести зворотню реакцію до кінця?
ЗАДАЧІ
1. У скільки разів зміниться швидкість реакції 2А + В ® А2В, якщо концентрацію речовини А збільшити в 2 рази?
2. Температурний коефіцієнт швидкості реакції дорівнює 2,3. У скільки разів зросте швидкість реакції, якщо підвищити температуру на 25 0С?
3. В якому напрямку зміщується рівновага реакції: 2NO +O2 ↔ 2NO2,
якщо збільшувати концентрації вихідних речовин?
4. В якому напрямку зміститься рівновага
2CO(г) + O2(г) «2CO2(г) DН = -566 кДж
N2(г) + O2(г) «2NO(г) DН = 180 кДж
А) при зниженні температури? В) при підвищенні тиску?
ТЕМА: Концентрації розчинів. Приготування розчинів.
Розчини – гомогенні системи, що складаються з двох або більше компонентів. Розчинені речовини рівномірно розподілені у вигляді молекул, атомів або іонів у розчиннику. У випадку водних розчинів розчинником є вода.
Розчинення супроводжується виділенням або поглинанням теплоти в наслідок хімічної взаємодії розчиненої речовини з розчинником. Цей процес називають сольватацією (у випадку неводного розчинника), або гідратацією, якщо розчинник вода.
Іноді молекули води так міцно з’єднані з частками розчиненої речовини, що при виділенні останнього з розчину у вигляді кристалів вода входить до їх складу. Кристали, що містять у своєму складі воду називають кристалогідратами. Розчини бувають насиченими, ненасиченими і пересиченими.
Насичений розчин – це розчин, який знаходиться у рівновазі з твердою фазою розчиненої речовини при даній температурі.
Ненасичений розчин – це розчин, концентрація якого нижче за насичений при той самій температурі.
Пересичений розчин – це розчин, у якому розчиненої речовини міститься більше, чим у насиченому при даній температурі.
Розчинність – це здатність одної речовини розчинятися в іншій. Розчинність твердих речовин у рідині при зростанні температури зростає, а газів зменшується. При збільшенні тиску розчинність газів у рідині зростає, проте цей фактор не впливає на розчинність твердих тіл.
Концентрацією розчину називають кількість (або масу) розчиненої речовини, яка міститься у певному об’ємі розчину або розчиннику. Розчини з великою концентрацією розчиненої речовини називають концентрованими, а з малою – розведеними. Вміст розчиненої речовини у розчині може бути виражений безрозмірними одиницями – частками або відсотками, а також розмірними – молярною, моляльною або нормальною концентраціями.
1. Масова доля розчиненої речовини (w) показує число одиниць маси розчиненої речовини, що містяться у 100 одиницях маси розчину:

2. Молярна концентрація (СМ) показує кількість молів розчиненої речовини, що міститься в 1 л розчину:

3. Моляльна концентрація (Сm) показує кількість молів розчиненої речовини, що міститься в 1 кг розчиннику:

4. Нормальна (еквівалентна) концентрація (СN) показує кількість еквівалентів розчиненої речовини, що міститься в 1 л розчину:
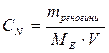
При розв’язуванні задач на розведення розчинів еквівалентної концентрації можна використовувати відношення яке вказує на те, що об’єми реагуючих один з одним речовин зворотно пропорційні до їх еквівалентних концентрацій.
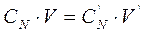
Молярна і еквівалентні концентрації зв’язані з масовою часткою відношеннями:

При приготуванні розчинів з кристалогідратів необхідно враховувати кристалізаційну воду.
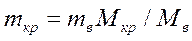
де, mкр і mв – маса кристалогідрату і безводної речовини,
Мкр і Мв – молярна маса кристалогідрату і безводної речовини.
В лабораторній практиці часто виникає необхідність з концентрованого розчину отримати розведений. Для цього зручно користуватися правилом діагональних схем („хреста”).
 w1 m1
w1 m1
w
w2 m2
де w - масова частка заданого розчину, w1- масова частка концентрованого розчину, w2 – масова частка розчину для розведення (у випадку з водою вона дорівнює 0), m1 і m2 – маси вихідних розчинів. m1=w-w2, m2=w1-w.
Date: 2015-09-02; view: 715; Нарушение авторских прав