
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 5
|
|
Визначення теплоти нейтралізації сильної кислоти сильною основою.
Мета роботи: визначити теплоту реакції нейтралізації сильної кислоти сильною основою методом калориметрії.
Прилади та реактиви: лабораторний штатив, пробірки, газовідвідні трубки, лучина, спиртівка. Цинк. Порошок оксиду купруму (ІІ). Перманганат калію. Розчини: хлороводневої кислоти, йодиду калію, сірчаної кислоти,3% пероксиду гідрогену, нітрату ртуті (ІІ).
Робота проводиться в спрощеному калориметрі. Калориметр складається з двох стаканів: зовнішнього – ємністю 250-300 мл і внутрішнього – ємністю 100 мл, коркової підставки, на якій розміщають внутрішній стакан для зменшення тепловіддачі, картонної покришки і термометра.
Зважити на терезах сухий калориметричний стакан. Зібрати калориметричний прилад (див. малюнок) і через лійку налити до стакану певний об’єм 1 М розчину гідроксиду натрію. Виміряти температуру лугу (ТЛ). Налити до мірного циліндру такий самий об’єм 1 М розчину хлороводневої кислоти та визначити температуру її розчину (ТК). Початкова температура суміші кислоти і лугу є середнім арифметичним (Т1) від ТЛ і ТК.
При працюючий мішалці налити до калориметричного стакану через лійку розчин кислоти і відмітити саму високу температуру (Т2), яку покаже термометр після зливання розчинів. Дані досліду занести до таблиці:
| Маса калориметричного стакану (m1), кг | Сумарний об’єм рідини у стакані (V), мл | Температура, К | |||
| ТЛ | ТК | Т1 | Т2 | ||
За отриманими даними визначити:
§ масу рідини (m2) в калориметричному стакані, кг;
__________________________________________________________________
§ Сумарну теплоємність системи, враховуючи, що питома теплоємність скла С1 = 0,75*103 Дж/(кг*К), а С2 = 4,18*103 Дж/(кг*К)
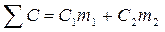
§ Кількість теплоти, що виділяється в реакції:
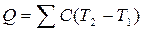
§ Число молів нейтралізованої кислоти (лугу) або число молів утвореної води, враховуючи задану молярну концентрацію і об’єм розчину:
ν = СМ * V
§ Теплоту нейтралізації  (кДж/моль Н2О)
(кДж/моль Н2О)
ΔН = 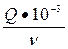 , кДж/моль.
, кДж/моль.
Теоретичне значення ентальпії (ΔН) реакції нейтралізації сильної кислоти лугом дорівнює 56,5 кДж/моль. Визначте відносну помилку (у %) експериментально знайденого теплового ефекту:
η = 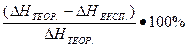
Записати термохімічне рівняння проведеної реакції нейтралізації.
Контрольні питання
1. Вивченням яких питань займається термохімія.
2. Сформулюйте основні термохімічні закони (Лавуаз’є-Лапласа, Гесса).
3. В чому суть наслідку із закону Гесса?
4. Як наслідок закону Гесса використовується для розрахунку теплового ефекту реакції.
5. Дайте визначення поняттю внутрішня енергія системи.
6. Дайте визначення поняттю ентальпія.
7. Чому дорівнюють ΔН і ΔS речовин О2 і Н2О?
8. При яких умовах ентропія змінюється. Навести приклади.
9. Як зміниться ΔS при розчиненні КСl та при випарюванні Н2О?
10. Які процеси називаються ізотермічними, ізобарними, ізохорними?
11. Як проводиться розрахунок ΔН і ΔS реакцій?
12. Назвіть стандартні умови при яких вивчають ΔН0, ΔS0, ΔG0
13. Сформулюйте принцип Бертло-Томпсена.
14. Дайте визначення ізобарно-ізотермічному потенціалу?
15. Зв’язок головних функцій стану термодинамічної системи.
Задачі
1. Користуючись таблицею стандартних ентальпій утворення визначте екзо – або ендотермічність реакції 2 NO + O2 = 2 NO2. Підрахуйте ΔН0 цієї реакції.
2. Підрахуйте зміну ентропії при випаровуванні одного моля води при 1000С і тиску 101,33 кПа (760 мм.рт.ст.).
3. Розрахуйте ΔG реакції NO (Г) + ½ O2 (Г) = NO2 (Г). В якому напрямку буде протікати ця реакція?
4. Користуючись табличними даними, покажіть, що в стандартних умовах при 25 С реакція Cu(к) + ZnO(к) = CuO(к) + Zn(к) неможлива.
ТЕМА: ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ
Кожна хімічна реакція протікає з визначеною швидкістю. Швидкість хімічних реакцій визначається зміною концентрації реагуючих речовин в одиницю часу:
v = (C0-C,)/t
Тут v — швидкість хімічної реакції, моль/(л-с), Со — початкова концентрація реагуючої речовини, моль/л, С1 - кінцева концентрація речовини, моль/л; t — час, с.
Швидкість хімічних реакцій залежить від різних факторів: природи реагуючих речовин, концентрації реагентів, температури, ступеню роздрібнювання твердих речовин, наявності і типу каталізатора.
Збільшення концентрації реагуючих речовин приводить до зростання числа зіткнень між частками (атомами, молекулами, іонами), у результаті чого швидкість реакції зростає. Вплив концентрацій на швидкість хімічної реакції відображає закон дії мас:
Швидкість хімічної реакції прямопропорційна добутку концентрацій реагуючих речовин.
Математично даний закон для гомогенної реакції мА + nВ = рС виражається так:
V = K[A]m[B]n
Тут k — константа швидкості реакції, СA і CB — концентрації речовин А и В.
Константа швидкості реакції має фізичний сенс швидкості реакції, коли добуток концентрацій реагуючих речовин дорівнює одиниці. Константа швидкості реакції залежить від природи реагуючих речовин, але не залежить від концентрації речовин.
У випадку гетерогенних реакцій у рівняння закону дії мас входять концентрації тільки тих речовин, що знаходяться в газовій фазі або розчині. Концентрація речовини, що знаходиться у твердій фазі, звичайно являє собою постійну величину і тому входить у константу швидкості. Наприклад, для реакції горіння вугілля С + О2 = СО2 закон дії мас запишеться так: v = kС02.
З ростом температури збільшується число активних зіткнень часток, що веде до підвищення швидкості реакції. Підвищення швидкості відбувається відповідно до правила Вант-Гоффа:
При підвищенні температури на 10 градусів швидкість реакції зростає в 2—4 рази.
Число, що показує, у скільки разів збільшується швидкість даної хімічної реакції зі зміною температури на 10 0С, називають температурним коефіцієнтом реакції. Математично ця залежність виражається рівнянням:
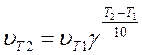
Тут uT1 — швидкість реакції при початковій температурі t1; uT2 — швидкість реакції при кінцевій температурі t2; g — температурний коефіцієнт.
У твердому стані взаємодія реагуючих часток може відбуватися тільки з поверхні. Тому швидкість реакції в цьому випадку буде залежати від ступеня розвитку поверхні: чим більше поверхня, тим вище швидкість реакції.
На швидкість хімічної реакції можуть впливати каталізатори. Каталізатори — це речовини, що змінюють швидкість реакції, але зберігають свій склад і кількість після проміжних реакцій. Каталізатори, що прискорюють реакцію, називають позитивними, а які сповільнюють — негативними.
Хімічна рівновага характерна для оборотних реакції, тобто реакцій, що можуть протікати як в прямому, так і в зворотному напрямку. З часом внаслідок зміни концентрації речовин (як вихідних так і продуктів) швидкість прямої і зворотної реакції становляться однаковими, то це означає, що система знаходиться у стані хімічної рівноваги.
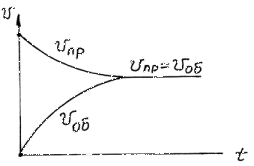
Розглянемо цей процес на прикладі зворотної гомогенної реакції в загальному вигляді:
mA + nB «pC + qD
Швидкість прямої реакції відповідно до закону діючих мас (1) визначається рівнянням:
u1 = K1 [A]m[B]n
Швидкість зворотньої реакції може бути визначена з рівняння:
u2 = K2 [C]p[D]q
У момент рівноваги u1 = u2 і K1 [A]m[B]n = K2 [C]p[D]q.
Звідки 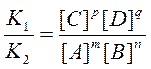
Співвідношення двох постійних величин К1/К2 є постійною і можна записати:
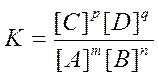 (3),
(3),
де [A], [B], [C], [D]- рівноважні концентрації речовин, що беруть участь в хімічній реакції, моль/л;
m, n, p, q –стехіометричні коефіцієнти у рівнянні реакції.
Величина К називається константою хімічної рівноваги і залежить від температури, природи реагуючих речовин і продуктів реакції, та не залежить від їх концентрацій. Отже хімічна рівновага в зворотних реакціях настає тоді, коли відношення добутку концентрацій утворених продуктів до добутку концентрацій вихідних речовин у відповідних ступенях стають рівними деякій постійній величині.
Хімічна рівновага при незмінних умовах може зберігатися довгий час. Якщо змінити зовнішні умови, в яких система була у стані рівноваги, то рівновага зрушується.
Напрямок зрушування хімічної рівноваги може бути визначений принципом Ле-Шательє.
Якщо змінити одну з умов при якій система знаходилася в рівновазі (концентрацію, тиск, температуру), то рівновага зміщується у напрямку реакції, що протидіє цій зміні.
Отже, збільшення концентрації вихідних речовин зрушує рівновагу в бік продуктів реакції.
Підвищення температури зрушує рівновагу у напрямку ендотермічного процесу, якщо реакція була екзотермічна.
Зростання тиску зрушує рівновагу газових реакцій у бік утворення речовин, що мають менший об’єм, або менша кількість молекул.
Date: 2015-09-02; view: 593; Нарушение авторских прав