
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 7
|
|
Приготування розчинів.
Мета роботи: виробити практичні навички приготування розчинів з даною масовою часткою, молярною, еквівалентною концентрація.
Прилади та реактиви: терези, термометр, циліндр для визначення густини, набір ареометрів, мірні циліндри (10-25 мл, 100 мл), мірна колба (200мл), хімічні та фарфорові стакани, скляна паличка, лійка, склянки для зливу приготованих розчинів. Гідроксид натрію кристалічний, розчин сірчаної кислоти (10-20%), сульфат натрію дека гідрат кристалічний, вода дистильована.
ДОСЛІД 1. Приготування розчину лугу з твердої речовини і води (200г 5% розчину гідроксиду натрію).
Розрахувати маси гідроксиду натрію та води. Зважити на терезах розраховану масу кристалічного гідроксиду натрію у попередньо зваженому стаканчику. Мірним циліндром відміряти розрахований об’єм води і перелити до фарфорового стакану. Внести до стакану наважку гідроксиду натрію і розчинити його шляхом перемішування скляною паличкою. Після розчинення охолодити розчин до 20 С, перенести до циліндру для визначення густини за допомогою ареометру.
Завдання. За таблицею густини визначити масову частку гідроксиду натрію у розчині, розрахувати похибку визначення. Розрахувати молярну і еквівалентну концентрації розчину.
ДОСЛІД 2. Приготування розчину кислоти з більш концентрованого (100г 2% розчину сірчаної кислоти).
Визначити густину вихідного розчину кислоти. Розрахувати необхідний об’єм вихідного концентрованого розчину і води для приготування заданого розчину. Мірним циліндром на 100 мл відміряти розрахований об’єм води і вилити до стакану. Другим циліндром на 10-25 мл відміряти об’єм розчину сірчаної кислоти і малими порціями перенести перемішуючи до стакану з водою. Після охолодження розчину визначити його густину.
Завдання. За таблицею густини визначити масову частку сірчаної кислоти у розчині, розрахувати похибку визначення. Розрахувати молярну і еквівалентну концентрації розчину.
ДОСЛІД 3. Приготування розчину молярної або еквівалентної концентрації з твердої речовини і води (200 мл 0,5н. розчину сульфату натрію з кристалогідрату Na2SO4*10H2O).
Визначити масу кристалогідрату необхідну для приготування розчину. Зважити на терезах розраховану масу солі з точністю до 0,001 г. крізь лійку зсипати наважку солі до мірної колби на 200 мл. Змити всі кристали з лійки. Наважку розчинити у невеликій кількості води, довести рівень рідини до мітки водою. Визначити густину виготовленого розчину і перелити його у підготовлену склянку.
Завдання. За таблицею густини визначити масову частку сульфату натрію у розчині, розрахувати похибку визначення. Розрахувати за формулами молярну і еквівалентну концентрації розчину.
Контрольні питання
1. Що називають розчином, розчинником?
2. Як розділяють розчини за ступенем насиченості?
3. Розчинність речовин та їх залежність від температури та тиску. Закон Генрі. Закон Дальтона.
4. Пояснити характер зміни розчинності газів в рідині при зміні парціального тиску газу і температури системи.
5. Що уявляють собою кристалогідрати?
6. Що називають концентрацією розчину?
7. Які існують найбільш розповсюджені способи виразу концентрації?
задачі
1. 20г нітрату натрію розчинили у 60г води. Визначити масову частку речовини у розчині.
2. До 500г 2%-го розчину хлориду натрію додали 100г цієї ж солі. Визначити масову частку речовини у новому розчині.
3. Скільки літрів 0,1 н. розчину перманганату калію можна отримати з 2,5л його 0,5 н. розчину?
4. Яка маса гідроксиду натрію необхідна для приготування 2л 0,5М розчину?
ТЕМА: ЗАМЕРЗАННЯ І КИПІННЯ РОЗЧИНІВ НЕЕЛЕКТРОЛІТІВ
Пружність пари над чистим розчинником завжди більша, ніж над розчином.
Внаслідок цього, щоб пружність пари досягла зовнішнього (атмосферного) тиску, розчин треба нагрівати до більшої температури ніж чистий розчинник. Тому температура кипіння розчинів завжди більша, ніж температура кипіння чистого розчинника.
Також наслідком зменшення пружності пари над розчином є зменшення його температури замерзання порівняно з температурою замерзання чистого розчинника.
Треба звернути увагу, що вищезазначені зміни температур замерзання та кипіння розчинів не залежать від природи розчиненої речовини, а визначаються тільки кількістю частинок (молекул або частинок іншої природи) розчиненої речовини, що міститься в однаковій масі розчинника.
ІІ закон Рауля: Зниження температури замерзання та підвищення температури кипіння розчину пропорційні моляльній концентрації розчиненої речовини.
Математично залежність зміни температури замерзання та температури кипіння від концентрації розчину записується у вигляді рівнянь:
Δtзам = Ккр · Сm (1)
Δtкип = Ке · Сm (2),
Де Δt – пониження температури замерзання або підвищення температури кипіння розчинів;
Ккр та Ке – кріоскопічна* та ебуліоскопічна** константи відповідно;
Сm – моляльна концентрація розчину, що показує кількість розчиненої речовини у 1000 г розчинника; одиниця розміру [моль/кг].
Якщо маємо “m” грамів речовини, що розчинені в “L” грамах розчинника, то моляльна концентрація має вигляд:
C=  (3)
(3)
Підставимо (3) у рівняння (1) і (2) маємо:
Δtзам = 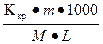 (4);
(4);
Δtкип =  (5),
(5),
де М – молярна маса розчиненої речовини.
* від грецького слова “kzyos” – холод; ** - від латинського слова ebullio – википати.
Якщо у рівняннях (1) і (2) підставити С = 1 моль / кг, то
Δtзам = Ккр (6)
Δtкип = Ке (7),
тобто - кріоскопічна константа Ккр показує, на скільки градусів знижується температура замерзання одномоляльного розчину порівняно з температурою замерзання чистого розчинника; вона залежить тільки від природи розчинника: для води Ккр = 1,86: для бензолу Ккр = 5,1; для оцтової кислоти Ккр =3,9;
- ебуліоскопічна константа Ке показує на скільки градусів вище кипить одномоляльний розчин неелектроліту порівняно з чистим розчинником; вона залежить тільки від природи розчинника: для води Ке = 0,52; для бензолу Ке = 5,5; для оцтової кислоти Ке = 16,65.
З вищеозначеного можна зробити висновок, що зниження температури замерзання одномоляльних водних розчинів неелектролітів, які містять 6,02*1023 молекул (1 моль, число Авогадро) вуглеводу сахарози, фруктози або глюкози дорівнює – 1,860, тому що кріоскопічна константа води дорівнює -1,860.
Аналогічно водні одномоляльні розчини киплять при температурі 0,520 вище, ніж чиста вода, тобто при температурі 100,520 С (за умовою нормального атмосферного тиску, що дорівнює 760 мм рт.ст. або 101,325 кПа).
З рівнянь (4) і (5), визначивши Δtзам або Δtкип, можна підрахувати молярні маси розчинених неелектролітів. Відповідно до процесів розпізнають кріоскопічний або ебуліоскопічний метод визначення молярних мас речовин.
Кріоскопічний метод є особливо цінним для речовин, які не можна перетворити у стан пари (білки, цукор, глюкоза, фруктоза тощо). Молярна маса розчиненої речовини підраховується з формули:
М = 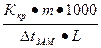 (8)
(8)
Для визначення температури замерзання розчинів використовується прибор кріоскоп (ТИП ОХ-9). Прибор складається з батарейного стакану об’ємом 2 л закритого кришкою з органічного скла. В центрі кришка має великий отвір, в який вставляється гумова втулка. У втулку ставлять пряму пробірку великого діаметру, що відіграє роль повітряної сорочки для пробірки з відростком. Остання призначена для дослідженого розчину. Ця пробірка закрита пробкою з двома отворами: один – для метастатичного термометра, а другий для мішалки, що зроблена з нержавіючої сталі.
Для визначення температури охолоджуючої суміші у стакан крізь втулку у кришці опускають лабораторний термометр. Перед початком роботи треба підготовити метастатичний термометр на інтервал температур близьких до 00 С.
Date: 2015-09-02; view: 558; Нарушение авторских прав