
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 2
|
|
Визначення молярної маси еквіваленту металу (Mg, Al або Zn) методом витиснення Гідрогену.
Мета роботи: визначити еквівалент та еквівалентну масу металу методом витискування Гідрогену та ознайомитись з методикою розрахунку, пов’язаною з законом еквівалентів.
Прилади та реактиви: терези, конічна пробірка, газовідвідна трубка, штатив, бюретки, наважка металу (цинку, алюмінію, магнію), сульфатна або хлоридна кислота.
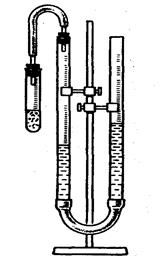
Метод оснований на вимірюванні об’єму Гідрогену, який виділяється з кислоти при дії на неї металу.
Для цієї мети застосовують прибор (див. мал.), який складається з двох бюреток, закріплених на штативі та з’єднаних резиновою трубкою. У таку сполучену судину наливають воду приблизно до половини бюреток. Одну з бюреток зверху закривають пробкою з відвідною трубкою, до якої приєднують пробірку, де відбувається реакція між кислотою та металом. Інша бюретка служить приймачем води, яка витискується при реакції воднем.
Об’єм виділеного гідрогену визначають за різницею рівнів води в будь–якій бюретці до та після досліду при тиску в закритій бюретці, який дорівнює атмосферному. Тиск газу в закритій бюретці дорівнює атмосферному, якщо вода в обох бюретках знаходяться на одному рівні.
Навіть при кімнатній температурі пар над поверхнею води має помітний тиск. Це треба враховувати при розрахунку об’єму газу, зібраного над водою. Тому для визначення парціального тиску Гідрогену необхідно від загального (атмосферного) тиску, під яким знаходиться Гідроген, відняти тиск насиченої водяної пари h:
PH2 = Ратм – h.
Для приведення об’єму виділеного гідрогену до нормальних умов використовують рівняння газового стану:
 =
= 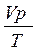 ,
,
де V0 – об’єм Гідрогену при н. у., мл;
р0 – парціальний тиск Гідрогену при н. у., яке дорівнює 101,3 кПа;
Т0 – температура, 273 К;
V – об’єм Гідрогену при даних умовах, мл;
р – парціальний тиск Гідрогену при умовах досліду, який дорівнює ратм – h, кПа;
Т – температура досліду, К.
Після визначення об’єму Гідрогену при н.у., визначають масу одного моля еквіваленту металу:
m (г) металу витискають V0 мл гідрогену
х»»» 11200»»
Отримайте наважку у лаборанта. В пробірку налийте соляної кислоти (на одну чверть пробірки); підтримуючи пробірку в нахиленому стані помістить наважку металу (не опускаючи в кислоту) на стінку в отвір пробірки та закрийте пробірку пробкою з відвідною трубкою від бюретки.
Перевірте герметичність приладу. Для цього, не торкаючись бюретки з пробіркою, перемістить іншу бюретку разом з лапкою штативу так, щоб рівень води у неї став на 5-10 см вище, ніж в першій бюретці. Якщо різниця у рівнях не змінюється прилад справний („тримає”); якщо рівні в бюретках вирівнюються, прилад не герметичний, пропускає повітря, про що слід повідомити лаборанта.
Приведіть воду в бюретках до однакового рівня та відмітьте рівень води у відкритій бюретці (мл). Відлік проводьте по нижньому меніску води з точністю до 0,1 мл.
П р и м і т к а. При однакових рівнях води в бюретках вони повинні бути закріплені так, щоб бюретка без пробірки стояла декілька вище бюретки з пробіркою.
Струсіть метал в кислоту (змийте його кислотою). Спостерігайте виділення Гідрогену та витиснення води з бюретки.
По закінченні реакції дайте пробірці охолонути на повітрі, після чого знову приведіть воду в бюретках до однакового рівня. Запишіть новий рівень води у відкритій бюретці. По різниці рівнів води до та після реакції розрахуйте об’єм виділеного гідрогену.
За даними досліду визначте молярну масу еквіваленту металу. Порівнюючи її з теоретичним значенням молярної маси еквіваленту металу (Mg, Al, Zn), визначте який метал був взятий для реакції.
Завдання.
Запишіть:
-наважка металу, г- ________________________________________________
-рівень води у бюретці до реакції, мл - ________________________________
-рівень води у бюретці після реакції, мл -______________________________
-температура, К -__________________________________________________
-атмосферний тиск, кПа -___________________________________________
-тиск водяної пари, кПа -___________________________________________
-тиск Гідрогену, кПа -_____________________________________________
За отриманими даними розрахуйте:
1. Об’єм виділеного Гідрогену.
____________________________________________________________________________________________________________________________________________
2. Об’єм Гідрогену при нормальних умовах.
______________________________________________________________________
3. Теоретичну молярну масу еквіваленту Mg, Al, Zn.
__________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Дослідну молярну масу еквіваленту металу.
______________________________________________________________________
5. Помилку досліду: а) абсолютну, б) відносну.
а)_____________________________________________________________________б)____________________________________________________________________
Запишіть рівняння реакції взаємодії металу з соляною кислотою та зробіть висновок.
__________________________________________________________________________________________________________________________________________________________________________________________________________________
КОНТРОЛЬНІ ПИТАННЯ
1. Що називають еквівалентом речовини?
______________________________________________________________________
______________________________________________________________________
2. Що називається еквівалентною масою?
____________________________________________________________________________________________________________________________________________
3. Сформулювати закон еквівалентів та написати математичне його визначення.
__________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Що таке моль еквівалентів та молярна маса еквівалентів?
__________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Якими методами можливо визначити еквіваленти елементів?
__________________________________________________________________________________________________________________________________________________________________________________________________________________
ТЕМА: БУДОВА АТОМА. ПЕРІОДИЧНИЙ ЗАКОН І
ПЕРІОДИЧНА СИСТЕМА Д.І.МЕНДЕЛЄЄВА.
І. Будова атома.
До кінця ХІХ ст., в хімії панувало уявлення, що атом це найменша частинка простої речовини, що він неподільний. Відкриття катодних променів та явище радіоактивності показало, що атом має складну будову.
Після дослідів з α частинками Е.Резерфорд запропонував одну з перших моделей будови атома – планетарну. Будучи недостатньо науковою вона не могла відповісти на питання щодо стабільності атома та природи лінійних спектрів газів.
Створення квантової теорії М.Планка дало змогу Н.Бору сформулювати основні положення своєї теорії у вигляді постулатів. Але й ця теорія була досить недосконалою, так як не могла з’ясувати місце знаходження електрона при переході з одного квантового рівня на інший, та її застосування було обмежено лише атомом Гідрогену.
20 роки ХХ ст. дали новий поштовх для розвитку теорії будови атомів. Завдяки роботам Де-Бройля, Е.Шредінгера, В.Гейзенберга та ін. було розроблено основи хвильової теорії про подвійну корпускулярно-хвильову природу світла; Де-Бройлем було виведено основне рівняння хвильової механіки: 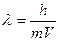 . З цього рівняння випливає, що частинки з масою m, яка рухається з швидкістю u, відповідає хвиля довжиною λ. Це рівняння можна використовувати для характеристики руху не лише фотону, але й інших матеріальних частинок: електрона, протона, нейтрона та ін.. Отже електрон є одночасно частинкою і хвилею. У 1925р. В.Гейзенберг запропонував принцип невизначеності, згідно з яким неможна одночасно становити місце перебування електрона у просторі, його швидкість, імпульс. Все це дало змогу сформулювати сучасну модель будови атома:
. З цього рівняння випливає, що частинки з масою m, яка рухається з швидкістю u, відповідає хвиля довжиною λ. Це рівняння можна використовувати для характеристики руху не лише фотону, але й інших матеріальних частинок: електрона, протона, нейтрона та ін.. Отже електрон є одночасно частинкою і хвилею. У 1925р. В.Гейзенберг запропонував принцип невизначеності, згідно з яким неможна одночасно становити місце перебування електрона у просторі, його швидкість, імпульс. Все це дало змогу сформулювати сучасну модель будови атома:
1. Основується на корпускулярно-хвильовій природі електрона.
2. Розглядає ймовірність знаходження електрона у просторі навколо ядра.
3. Електронна густина нерівномірно розподілена навколо ядра.
4. Атомна орбіталь – простір навколо ядра, де вірогідність знаходження електрона 90%.
5. Атомне ядро
 |  | ||
нейтрони протони
n01 р+1
Ar = Z + N, де Z – кількість протонів,
N – кількість нейтронів.
Ядро заряджено позитивно, а електрони заряджені негативно. Атом в цілому електронейтральний завдяки взаємній компенсації зарядів.
Ізотопи – атоми з однаковим зарядом ядра, але різною масою.

 4018Ar і 39 18 Ar; 11H, 21D, 31 Т.
4018Ar і 39 18 Ar; 11H, 21D, 31 Т.
Ізобари – атоми з однаковою масою, але різними зарядами.
4018 Ar і 4019К.
Стан електронів в атомі характеризується набором певних характеристик – квантових чисел. Всього виділяють чотири квантових числа: n, l, m, s. Щоб з’ясувати суть квантових чисел треба зрозуміти, що всі ці числа характеризують електрони на різних енергетичних рівнях в атомі.
Рівні
N = 1 2 3 4
|




ядро
підрівні s s p s p d s p d f
L = 0 0 1 0 1 2 0 1 2 3
орбіталі

 m = ↑↓
m = ↑↓
 ↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑

 s = ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑
s = ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑
Кожний рівень складається з підрівнів, а кожен підрівень з орбіталей, на
яких і знаходяться електрони.
N – головне квантове число; приймає значення від 1 до ∞ і характеризує енергію електрона в атомі або на рівні та розмір електронної хмари.
Енергетичні рівні з різним значенням (N) прийнято позначати великими латинськими літерами.
n = 1 2 3 4 5 6 7
рівні К L M N O P Q
якщо n = 3, це означає, що електрон знаходиться на 3 рівні. По значенню (n) можна визначити максимальну кількість електронів на рівні:
N = 2 n2
L – орбітальне квантове число характеризує енергію електрона на підрівні та форму електронної орбіталі.
Приймає значення від 0 до (n - 1), кожному значенню L відповідає певний підрівень.
L = 0 1 2 3
підрівень s р d f
Якщо L = 3, це означає, що електрон знаходиться на f- підрівні. Кількість підрівнів дорівнює номеру рівня – s, р і т.д. (див. схему). Кількість електронів на підрівні розраховується за формулою: N = 2(2l + 1) звідси Nе (s) = 2; Nе (р) = 6; Nе (d) = 10; Nе (f) = 14.
m – магнітне квантове число характеризує орієнтацію орбіталів у просторі. Воно визначає кількість орбіталей в одному й тому електронному рівні і розраховується по формулі (2L + 1).
m = 0 -1,0,1 -2,-1,0,+1,+2 -3,-2,-1,0,+1,+2,+3
Кількість 1-s 3-р 5-d 7-f
орбіталей
S - спінове квантове число характеризує оберт електрона навколо власної осі. Значення +½ і -½.
 ↑↓
↑↓
Заповнення енергетичних рівнів у не збуджених атомах відбувається згідно з принципом найменшої енергії: найбільш стійким станом електронів в атомі відповідає мінімальна із можливих його енергій. Тому спочатку заповнюються рівні з найменшою енергією. Зміст енергії електрона визначається
Правилом В.М.Клечковського:
· заповнення електронних шарів йде у напрямку збільшення сум головного і орбітального квантових чисел (n + l).
Звідси зрозуміло, чому зразу заповнюється 4s підрівень, а потім 3d тобто:
для 4s (n + l = 4), а для 3d (n + l = 5), якщо сума однакова, то спочатку йде заповнення підрівня з найменшим значенням (n).
При заповненні електронних рівнів крім правила Клечковського використовують принцип Паулі і правило Хунда.
Принцип Паулі: в атомі не може бути двох електронів з однаковим значенням всіх чотирьох квантових чисел.
Це означає, що на одній орбіталі може бути більш 2-х електронів для яких значення n, m, l однакові, а спіни антипаралельні
| ↑↓ |
Правило Хунда: при заповненні енергетичних підрівнів електрони розташовуються так, щоб їх сумарний спін був максимальний.
 |  |

↑↓ ↑↓ Не вірно
 |  |

↑↓ ↑ ↑ вірно
ІІ. Періодичний закон та періодична система елементів Д.І.Менделєєва.
На початку 60 р.р. ХІХ ст. після затвердження атомно-молекулярної теорії почалось різностороннє вивчення властивостей відомих на той час елементів. Продовжувалось відкриття нових. Такі вчені, як А.Лавуазьє, Я.Берцеліус, І.Деберейнер, Л.Мейєр – усі ті, хто до Д.І.Менделєєва намагались зробити класифікацію елементів.
Аналізуючи дані про внутрішні зв’язки між групами подібних за властивостями речовин, Д.І.Менделєєв дійшов висновку, що хімічні та фізичні властивості повинні зумовлюватися більш фундаментальними та загальними характеристиками хімічного елементу. Такою характеристикою, він вважав, є атомна маса.
У 1871р. Д.І.Менделєєв сформулював суть періодичного закону в такій стислій формі:
Властивості елементів, а також властивості утворених ними простих і складних тіл перебувають у періодичній залежності від величини атомних ваг елементів.
Дослідження Г.Мозлі і Д.Чедвіка встановили, що порядковий номер елемента в періодичній системі співпадає з величиною заряду ядра даного елемента, а також порушення розташування елементів у напрямку збільшення атомних мас (аргон, кобальт та ін.) привели до того, що за більш фундаментальну характеристику елемента стали брати не атомну масу, а заряд ядра, і тому сучасна трактовка періодичного закону виглядає так:
Властивості елементів знаходяться в періодичній залежності від величини заряду ядра їх атомів.
Звідси випливає, що порядковий номер елемента в періодичній системі це не просто номер по порядку, а що він має певний фізичний зміст – відповідає заряду ядра атома даного елемента.
Періодична система – це графічне відображення періодичного закону.
Основними структурними одиницями періодичної системи є період і група.
Період – горизонтальний ряд, в якому елементи розташовані у порядку зростання їх атомних мас (порядкового номера). Всього 7 періодів. Кожен період починається лужним металом (крім 1-го) і закінчується благородним газом. Перші 3 періоди малі або типові, інші – 4 великі.
У малих періодах із збільшенням порядкового номеру спостерігається поступове зменшення металічних і збільшення неметалічних властивостей.
У великих періодах ця закономірність ускладнена. Наприклад, у 5-му періоді починаючи з Rb металічні властивості зменшуються і досягають мінімуму
У платинових: Ru, Rh, Pd, але після срібла йде Сd у якого спостерігається стрибкоподібне зростання металічних властивостей, що із зростанням порядкового номеру закономірно переходить у типові неметалічні властивості у йоду.
Закінчується великий період, як і малі, благородним газом – ксеноном (для 5-го). Періодична зміна властивостей елементів в середині періоду дає змогу розділити їх на 2 ряди, де друга частина повторює першу. Тому пасивні метали родини платини можна розглянути, як аналог благородних газів, а цинк, кадмій, ртуть – як аналог земельних металів.
Група – вертикальний ряд, в якому розміщенні подібні за властивостями елементи. Всього 8 груп. З кожного малого періоду до групи входить по одному типовому елементу, а з кожного великого періоду, який поділяється на 2 півперіоди – по два елементи, один з яких є повний, а другий – неповний аналог типових елементів.
Отже в групах об’єднуються не тільки подібні за хімічними властивостями елементи, а й елементи, що значно відрізняються один від одного.
У групах зверху вниз зростають металічні властивості. Так в першій групі найактивнішим металом є францій.
Крім заряду ядра і атомною масою кожен атом елемента характеризується енергією іонізації, спорідненістю до електрону, електронегативністю.
Енергія іонізації – енергія, яка потрібна для перетворення атома в іон.
В періодах вона зростає, а в групах – зменшується.
Спорідненість до електрону – енергія, яка виділяється при приєднанні електрону до атому.
В періоді - зростає, а в групах – зменшується.
Електронегативність – відносна здатність атома відтягувати на себе електронну густину.
В періоді - зростає, а в групах – зменшується.

Значення періодичного закону.
І. Природничо-наукове:
1. Це основа для класифікації елементів.
2. Дає можливість передбачити нові елементи і їх властивості.
ІІ. Філософське.
В періодичному законі і системі елементів знайшли відображення закони діалектики:
1. Єдність і боротьба протилежностей.
2. Перехід кількості в якість.
3. Заперечення заперечень.
ІІІ. Періодична система і будова атома
Між знаходженням атома елемента в періодичній системі та його будовою є взаємний зв’язок.
1. Порядковий номер показує кількість протонів і електронів в атомі.
2. Номер періоду показує кількість енергетичних рівнів в даному атомі, звідси зрозуміло чому в першому періоді всього 2 елементи. Так як 1-му періоді лише один енергетичний рівень і 1 підрівень s на якому максимум може бути 2 електрони: 1s1 у гідрогену і 1s2 у гелію.
3. Номер групи показує максимальну валентність, а для s.p-елементів кількість електронів на останньому рівні; звідси зрозуміло, чому С І Ті в різних підгрупах; так як електронна конфігурація останнього рівня різна, але число валентних електронів і максимальна валентність однакова.
ПРАВИЛО НАПИСАННЯ ЕЛЕКТРОННИХ ФОРМУЛ *.
1. В періодичній системі знаходимо порядковий номер елементу, його величина показує заряд ядра і загальну кількість електронів в атомі.
2. По періодичній системі знаходимо номер періоду даного елементу, його числове значення показує кількість енергетичних рівнів в даному атомі.
3. По періодичній системі знаходимо номер групи даного елементу, його числове значення показує: кількість електронів на останньому енергетичному рівні (якщо це s- чи р-елемент), якщо це d елемент, то їх, як правило, 2, а у деяких 1 (Cr, Nb, Mo, Ru, Rh, Pt, Cu).
4. Використовуючи формулу Ne = 2n2 записуємо максимальне число електронів на кожному рівні, крім передостаннього. Кількість електронів на передостанньому визначаємо як різницю між порядковим номером атому елементу і кількістю електронів в атомі, крім передостаннього рівня.
5. Записуємо електронну формулу користуючись правилом Клечковського, Хунда, Паулі.
Наприклад: записати електронну формулу Se.
1. Se 34 Z = +34; ∑ Nе = 34.



 2. Se 4 період
2. Se 4 період
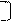


 3. VІ гр. р елемент, на останньому шарі 6 ē
3. VІ гр. р елемент, на останньому шарі 6 ē


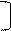
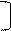 4. N ē = 2 n2 для 1-го N ē =2 6
4. N ē = 2 n2 для 1-го N ē =2 6
для 2-го N ē = 8
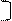

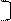
 х = 34 – 16 =18 2 8 х 6
х = 34 – 16 =18 2 8 х 6
2 8 18 6
5. 1s2 2s2 2р6 3 s2 3р6 4 s2 3d10 4р4
*це правило не придатне для написання електронної формули f-елементів.
Date: 2015-09-02; view: 752; Нарушение авторских прав