
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ход роботи
|
|
Зовнішню посудину кріоскопу (схема 2) заповнюють на ¾ об’єму охолоджуючою сумішшю з льоду або снігу і кухонної солі або нітрату амонію. Охолоджуючу суміш ретельно перемішують. При роботі з водними розчинами температура охолоджуючої суміші повинна бути на 5-7 0 С нижча за нуль.
У внутрішню пробірку налити 50 мл дистильованої води і, перемішуючи воду мішалкою, визначити температуру виділення кристалів льоду за термометром Бекмана, що був налагоджений на певний інтервал температур. Записати температуру замерзання дистильованої води (t'). Після цього витягнути пробірку з відростком, всипати у дистильовану воду 0,850 г глюкози (С6Н12О6). Коли глюкоза повністю розчиниться, пробірку з відростком знову ставлять у кріоскоп в охолоджуючу суміш. Помішуючи мішалками розчин глюкози та охолоджуючої суміші пильно стежити за зміною температури. Відмітити температуру, при якій з’являються перші кристали льоду. Це і буде температура замерзання даного розчину.
До робочого зошиту занести дані.
Маса глюкози – m, г
Маса розчинника (води) – L, г
Температура замерзання води – t' 0 C
Температура замерзання розчину – t 0 C
Кріоскопічна константа води (Ккр) – 1,86 0 С
Пониження температури замерзання розчину – Δt зам
З добутих даних, користуючись формулою (8) визначити молярну масу глюкози.
Підрахувати відносну помилку у процентах користуючись формулою:
П = 
Контрольні питання
1. Властивості розчинів неелектролітів.
2. Що вивчає кріоскопія?
3. Яка концентрація розчину називається моляльною?
4. Сформулюйте закони Рауля та запишіть їх у математичній формі.
5. Чому розчини киплять при більш високій і замерзають при нижчій температурі, ніж розчинники?
6. Який фізичний вміст кріоскопічної та ебуліоскопічної констант розчиннику?
задачі
1. При розчиненні 1,84 г цукру у 100 г води температура замерзання води знизилася на 10. Визначити молярну масу цукру. Кріоскопічна константа води дорівнює 1,860.
Відповідь: 342 г/моль
2. Яку масу етиленгліколю С2Н4(ОН)2 треба розчинити у 60 мл води, щоб приготувати антифриз з температурою замерзання – 40 0С?
Відповідь: 9кг.
3. Скільки грамів сахарози С12Н22О11 необхідно розчинити в 100г води, щоб: а) знизити температуру кристалізації на 1 градус; б) підвищити температуру кипіння на 1 градус?
Відповідь: а) 18,4г; б) 65,8г.
ТЕМА: ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ.
Речовини, які в розплавленому або в водному розчині проводять електричний струм (кислоти, солі, основи) відносяться до електролітів. При розчиненні в воді електроліти дисоціюють на позитивно і негативно заряджені іони.
KA «K+ + A-
Розпад електролітів на іони під дією полярних молекул розчинника, називається електролітичною дисоціацією.
Позитивно заряджені іони – катіони (наприклад, іони гідрогену і металів), негативно заряджені іони – аніони (наприклад, кислотні залишки, гідроксид-іони).
Процес електролітичної дисоціації зображують, користуючись хімічними рівняннями. Наприклад, дисоціація НСІ зображується так:
НСІ → Н+ + СІ-
Електролітична дисоціація – процес оборотний для слабких електролітів. Ступінь електролітичної дисоціації α – це відношення кількості молей, що продисоціювали на іони (х), до загальної кількості молей в розчині електроліту (n).
 , або
, або 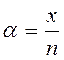 * 100%
* 100%
Електроліти можна поділити на дві групи: сильні і слабкі.
Сильні електроліти в водних розчинах дисоціюють практично повністю. Поняття ступені дисоціації до них по суті не застосовано.
До сильних електролітів належать майже всі солі найважливіших кислот і основ. До них відносяться HNO3, H2SO4, HCI, HBr, HI, NaOH, Ba(OH)2, Ca(OH)2.
Слабкі електроліти в водних розчинах дисоціюють тільки частково, і в розчині встановлюється динамічна рівновага між недисоційованими молекулами і іонами
До слабких електролітів відносяться більшість органічних кислот, а з найважливіших неорганічних сполук: H2S, H2CO3, HCN, H2SO3, NH4OH.
Ступінь дисоціації залежить від природи електроліту, розчинника, концентрації, температури. При розведенні розчину ступень дисоціації зростає.
До рівноваги, що встановлюється в розчині слабкого електроліту між молекулами і іонами, можна застосувати закони хімічної рівноваги і записати вираз константи рівноваги.
Константа дисоціації чисельно дорівнює відношенню добутку концентрацій іонів, на які розпався електроліт, до непродисоційованих молекул.
Наприклад, для дисоціації гідроксиду амонію:
NH4 ↔ NH4+ + OH-
Константа рівноваги має вигляд:

Величина К залежить від природи електроліту і розчинника, а також від температури, але не залежить від концентрації розчину. Вона характеризує спроможність даної кислоти або основи розпадатися на іони. Чим більш К, тим легше електроліт дисоціює.
Для слабких електролітів константа і ступень дисоціації знаходяться в математичній залежності (закон розведення Освальда):
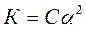 ,
,
де С – концентрація електроліту, моль/л.
Теорія електролітичної дисоціації визначає кислоти, як електроліти, що дисоціюють в розчинах з утворенням тільки іонів гідрогену. Багатоосновні кислоти, а також основи 2-х і більш валентних металів дисоціюють по ступеням. В розчинах цих речовин встановлюються складні рівноваги, в яких беруть участь іони різноманітного вигляду. Наприклад, дисоціація сірчаної кислоти відбувається в 2 ступеня:
H2SO4 → H+ + HSO4-
HSO4- → H+ + SO4 2-
Основи – це електроліти, що дисоціюють в розчинах з утворенням тільки гідроксид - іонів. Основи також дисоціюють по ступенях:
Са(ОН)2 → СаОН+ + ОН-
СаОН+ → Са2+ + ОН-
Солі – це електроліти, що дисоціюють в водномурозчині на катіони металу і аніони кислотного залишку. Наприклад:
КСІ → К+ + СІ-
Na2SO4 → 2 Na+ + SO42-
Згідно теорії електролітичної дисоціації, реакції між кислотами, основами і солями в водних розчинах протікають між іонами, на які розпадаються молекули цих речовин. Напрямок реакції між іонами йде в сторону утворення важкорозчинних, летких, малодисоціюючих речовин і комплексних іонів.
В іонному рівнянні важкорозчинні, газоподібні і слабкі електроліти пишуться у вигляді молекул. Добре розчинні сильні електроліти – у вигляді іонів. Наприклад,
BaCI2 + 2AgNO3 = Ba(NO3)2 + 2AgCI↓
Ba2+ + 2CI- + 2Ag+ + 2NO3- = Ba2+ + 2NO3- + 2AgCI↓
2CI- + 2Ag+ = 2AgCI↓
Date: 2015-09-02; view: 597; Нарушение авторских прав