
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 1
|
|
Властивості основних класів неорганічних сполук.
Мета роботи – повторити матеріал середньої школи, пригадати символіку, класифікацію і номенклатуру хімічних сполук, їх хімічні властивості і способи отримання.
Прилади та реактиви: спиртівка, залізна ложечка, скляна паличка, фарфоровий тигель, шматочок натрію (калію). Розчини: хлороводневої кислоти, ферум хлориду (ІІІ), купрум сульфату, натрій гідроксиду, цинк сульфату, натрій сульфату, барій хлориду. Фенолфталеїн. Дистильована вода.
Дослід 1. Одержання оксидів лужних металів.
Взяти пінцетом шматочок натрію (калію), обережно покласти його на фільтровальний папір та обрізати окисну плівку з поверхні металу. Нагріти натрій на залізній ложечці доки він не займеться.
Завдання.
Записати рівняння хімічної реакції проведеного досліду
______________________________________________________________________
Визначити колір утвореного оксиду_________________________________
До якого типу відносяться оксиди лужних металів?____________________
Дослід 2. Одержання і властивості розчинних у воді основ.
Взяти пінцетом шматочок натрію та покласти його до фарфорового тиглю і додати по краплям води. Спостерігати процес розчинення натрію. Після повного розчинення внести краплю фенолфталеїну. Визначити реакцію середовища. По краплям внести хлоридну кислоту до знебарвлення фенолфталеїну в розчині.
Завдання.
Написати рівняння реакції утворення натрій гідроксиду з металічного натрію
______________________________________________________________________
Написати молекулярне та іонне рівняння взаємодії натрій гідроксиду з хлоридною кислотою
______________________________________________________________________
Зробити висновок про властивості натрій гідроксиду.
______________________________________________________________________
Дослід 3. Одержання та властивості важкорозчинних у воді основ.
До першої пробірки внести 5-7 крапель ферум хлориду (ІІІ), а до другої купрум сульфат і по краплям прилити розчин натрій гідроксид. Відмітити колір осадів. Додати розчин сірчаної або хлоридної кислоти до розчинення осадів.
Завдання.
Скласти рівняння реакцій в молекулярному та іонно-молекулярному вигляді.
1.___________________________________________________________________________________________________________________________________________2.___________________________________________________________________________________________________________________________________________3.___________________________________________________________________________________________________________________________________________4.___________________________________________________________________________________________________________________________________________
Зробити висновок про властивості гідроксидів феруму (ІІІ) і купруму (ІІ)
__________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 4. Одержання і властивості амфолітів.
Налити в дві пробірки 4-5 крапель розчину цинк сульфату. До кожної додати по краплям розчин натрій гідроксиду до утворення білого драглеподібного осаду цинк гідроксиду. До осадів при перемішуванні прилити: до першої пробірки – розчин хлоридної кислоти, до другої – натрій гідроксид.
Завдання.
Скласти рівняння реакції у молекулярному та іонно-молекулярному вигляді.
1.___________________________________________________________________________________________________________________________________________2.___________________________________________________________________________________________________________________________________________3.___________________________________________________________________________________________________________________________________________
Дослід 5. Одержання і властивості солей.
До пробірки внести розчин барій хлорид та додати розчин натрій сульфату. Спостерігати утворення важкорозчинної солі барій сульфат. Визначити колір утвореного осаду.
Завдання.
Написати рівняння реакції в молекулярному та іонному вигляді
__________________________________________________________________________________________________________________________________________________________________________________________________________________
КОНТРОЛЬНІ ПИТАННЯ.
1. На які класи діляться неорганічні сполуки?
____________________________________________________________________
2. Які сполуки називаються оксидами, основами, кислотами, солями?
Оксиди_________________________________________________________________________________________________________________________________Основи_________________________________________________________________________________________________________________________________Кислоти_________________________________________________________________________________________________________________________________Солі____________________________________________________________________________________________________________________________________
3. Що таке амфоліти?
____________________________________________________________________
4. Класифікація оксидів, основ, кислот і солей.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТЕМА: ЕКВІВАЛЕНТ ТА МОЛЯРНА МАСА ЕКВІВАЛЕНТУ
Еквівалент (Е) – це дійсна або умовна частка речовини, яка може заміщати, приєднувати, звільняти або бути будь–яким іншим чином еквівалентна одному іону гідрогену у кислотно–основних або іонообмінних реакціях або одному електрону в окисно–відновних реакціях. Також, як молекула, атом або іон, еквівалент безрозмірний. Та також, як у випадку молекул, атомів або іонів, склад еквіваленту виражають за допомогою хімічних знаків та формул.
Хімічний еквівалент простої речовини знаходять з відношення його атомної маси до валентності. Наприклад,

Хімічні еквіваленти складних речовин розраховують таким чином:
Еквівалент оксиду = мольна маса оксиду__________________
число атомів елемента×валентність елемента
Наприклад,

Еквівалент гідроксиду = мольна маса гідроксиду
кислотність гідроксиду
Наприклад:
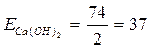
Еквівалент кислоти = мольна маса кислоти
основність кислоти
Наприклад,

Еквівалент солі = ________ мольна маса солі__________
число атомів металу* валентність металу
Наприклад,  .
.
Кількість речовин виміряють в молях. Один моль еквівалентів має стільки еквівалентів, скільки атомів міститься в 0,012 кг вуглецю–12. Маса моля еквівалентів називається молярною масою еквіваленту Ме.
Наприклад, молярні маси еквівалентів в розглянутих раніше реакціях дорівнюють:
Ме(ОН¯) = МОН¯ = 17 г/моль,
Ме(Са2+) = ½ МСа2+ = 20,04 г/моль і т.п.
Слід зупинитися на понятті об’єму моля еквівалентів газу. Як відомо, моль будь-якого газу при нормальних умовах займає об’єм, який дорівнює 22,4 л. Відповідно, для розрахунку об’єму моля еквівалентів газу необхідно знати число молей еквівалентів в одному молі газу. Наприклад, в реакції окислення гідрогену
½Н2 – е¯ = Н+ еквівалент газоподібного Гідрогену – це половина його молекули
Э(Н2) = ½ Н2. Тому один моль еквівалентів гідрогену займає при нормальних умовах об’єм 22, 4 л: 2 = 11,2 л.
Аналогічним чином можна показати, що об’єм одного моля еквівалентів Оксигену в реакції відновлення О2 + 4е¯ = 2О2– дорівнює 22, 4 л: 4 = 5,6 л.
Оскільки склад еквіваленту речовини залежить від реакції, то молярна маса еквіваленту однієї й тієї ж речовини може бути різною. Наприклад, молярна маса еквіваленту FeSO4 в реакції
FeSO4 + 2HCl = FeCl2 + H2SO4
дорівнює 75, 925 г/моль, а в реакції
2FeSO4 + Co(SO4)3 + Fe2(SO4)3 + 2CoSO4
дорівнює 151,85 г/моль, так як у першому випадку Э(FeSO4) = ½FeSO4, а в другому – Э(FeSO4) = FeSO4.
Закон еквівалентів: речовини реагують один з одним в еквівалентних співвідношеннях, тобто моль еквівалентів однієї речовини реагує з молем еквівалентів іншої речовини.
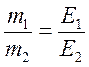
Наприклад, в реакції ½Zn + HCl = ½ZnCl2 + ½H2 один моль еквівалентів цинку (½ моль Zn) реагує з одним молем еквівалентів кислоти (1 моль HCl) з утворенням одного моля еквівалентів хлориду цинку (½ моль ZnCl2) та одного моля еквівалентів газоподібного гідрогену (½ моль Н2).
Закон еквівалентів для реакції
м А + п В = А м В п,
яка протікає в розчині, можна записати наступним чином:
VANA =VBNB,
де VA та NB – об’єми реагуючих розчинів; NA та NB – їх нормальні концентрації.
Експериментальне визначення еквівалентів може бути проведене різноманітними методами:
Date: 2015-09-02; view: 512; Нарушение авторских прав