
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гідроксі- і амінопіридини. Добування, таутомерія, кислотно-основні властивості
|
|
ОКСИПИРИДИНЫ (гидроксипиридины, пиридинолы), производные пиридина общей ф-лы C5H4_nN(OH)n.
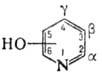
В зависимости от положения группы ОН различают 2-, 3- и 4-оксипиридины (соотв. -альфа,бета - и гамма-изомеры).
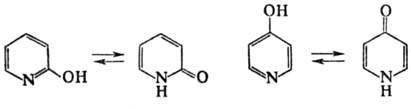
Оксипиридины-слабые основания (рКа для 2-, 3- и 4-оксипиридинов соотв. 0,8, 5,2 и 3,3) и слабые к-ты. Образуют соли с к-тами и щелочами (т. наз. пиридоляты). Все три моногидроксипиридина способны к прототропной таутомерии. Так, в водном р-ре 2- и 4-оксипиридины находятся преим. в кетоформах, наз. пиридонами; их соли имеют гидроксипи-ридиновую структуру.
Для 3-оксипиридина в водном р-ре характерно наличие нейтральной (Н) и биполярной (Б) форм в соотношении 1:1. В зависимости от рН среды он может также существовать в анионной (А) и катионной (К) формах:
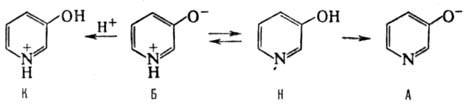
Все моногидроксипиридины с водными р-рами FeCl3 дают типичное для фенолов пурпурное окрашивание (у 2- и 4-оксипиридинов цвет менее интенсивен, чем у 3-оксипиридина). 2-Оксипиридин обладает флуоресценцией во всех формах, 3-оксипиридин -в формах К, Б и А.
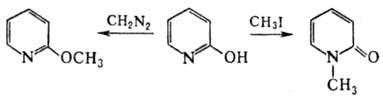
Алкилирование 3-оксипиридина может протекать по атому N или по атому О. Так, под действием СН3I или (CH3)2SO4 3-оксипиридин образует N-метил-3-гидроксипиридиниевые соли, под действием диазометана в р-ре трет-бутанола-3-метоксипири-дин. При ацилировании 3-оксипиридин образует только О-ацилпроиз-водные. 3-Оксипиридин проявляет св-ва, характерные для фенолов (реагирует с СН2О, вступает в р-цию Манниха, сочетается с солями диазония с образованием азокрасителей), напр.:

З-Оксипиридин бромируется и нитруется легко, сульфируется в жестких условиях. Наиб. реакционноспособно положение 2, наименее-4. В отличие от фенола 3-оксипиридин не вступает в р-ции ацилирования и алкилирования по Фриделю-Крафтсу. 2- И 4-оксипиридины при алкилировании алкилгалогенидами или этиленоксидом превращ. в N-алкилипиридоны, при действии диазометана соотв. в 2-метоксипиридин и смесь 4-мет-оксипиридина с N-метил-4-пиридоном, напр.:
Электроф. замещение 2- и 4-оксипиридинов протекает по положениям 3 и 5. 2-Оксипиридин аминометилируется с образованием N-замещенных оснований Манниха; 4-оксипиридин в эту р-цию не вступает. Гидрокси-метилирование 2-оксипиридинов, не замещенных по атому N, происходит по атому N, замещенных-в ядро.
2-Оксипиридин обычно получают диазотированием 2-аминопириди-на или гидроксилированием пиридина (пропусканием паров пиридина над КОН при 300-320 °С),
3-оксипиридин - сплавлением пиридин-3-сульфокислоты с КОН (170°С, 1-2 ч) или из 3-ами-нопиридина. Производные З-оксипиридиныа м. б. получены перегруппировкой 2-ацилфуранов при нагр. с водным или спиртовым р-ром аммиака:
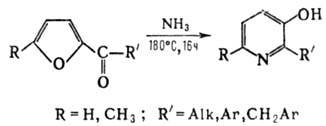
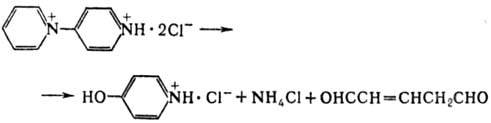
4-Оксипиридин получают обычно гидролизом 4-пиридиниопириди-нийдихлорида:
АМИНОПИРИДИНЫ. Аминопроизводные пиридина обладают более сильными основными свойствами, чем пиридин и анилин. Они содержат в своем составе два основных центра — атом азота пиридинового типа и атом азота аминогруппы.
Протонирование аминопиридинов происходит в первую очередь по атому N в цикле. В образующемся пиридиниевом катионе основность аминогруппы (рКа)уменьшается настолько, что ее протонирование происходит только в очень кислой среде.
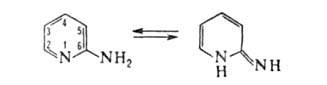
2- и 4-аминопиридины способны к таутомерному превращению соотв. в 2- и 4-пиридонимины, однако в обычных условиях существуют практически в аминной форме, напр.:
Моноаминопиридины обладают мн. св-вами первичных аминов. При взаимод. 2-аминопиридина с алкилирующими агентами (алкилгалогенидами, алкилсульфатами или диазометаном) алкилируется в первую очередь кольцевой атом N. В присут. NaNH2 образуется 2-алкиламинопиридин. Дальнейшим алкилированием получают диалкиламинопиридины. Существ. различие в хим. св-вах изомерных моноаминопиридинов проявляется в их р-циях с HNO2: 3-аминопиридин диазотируется с образованием солей диазония, 2- и 4-аминопиридины образуют в слабокислом р-ре гидроксипиридины (пиридоны), а в присут. конц. соляной к-ты - хлорпиридины. Соли диазосоединений из 2-аминопиридина получают по р-ции:
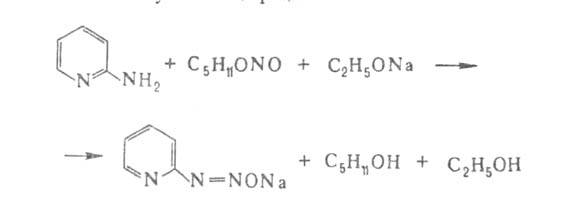
Моноаминопиридины реагируют с сильными электрофилами, восстанавливаются в производные пиперидина. Аминогруппа компенсирует дезактивирующий эффект атома N пиридина и ориентирует замещение в кольце. Если аминогруппа находится в положении 2, 3 или 4, то электроф. замещение происходит соотв. в положения 5, 2 или 3 (5). При действии на 2-аминопиридин нитрующей смеси образуется нитрамин, к-рый в присут. H2SO4 изомеризуется в смесь 5-нитро- и З-нитро-2-аминопиридинов с выходами соотв. 80 и 10%:
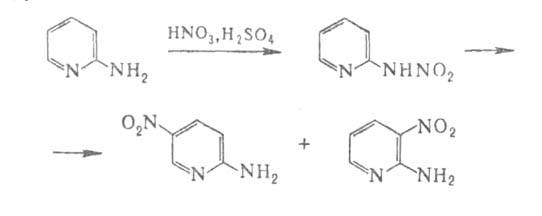
2-Аминопиридин получают аминированием пиридина амидом натрия по р-ции Чичибабина, 3-аминопиридин -обработкой никотинамида гипобромитом по р-ции Гофмана или аммонолизом 3-бромпиридина в присут. CuSO4, 4-аминопиридин - оглавлением 4-феноксипиридина с NH4C1, аммонолизом 4-хлорпиридина в присут. ZnCl2 или взаимод. изоникотинамида с гипобромитом по р-ции Гофмана.
Моноаминопиридины применяют для получения лек. ср-в и красителей. Известны все 6 изомеров диаминопиридина и 6 изомеров триаминопиридина. По способам получения и хим. св-вам эти соед. аналогичны моноаминопиридинам. Продукт азосочетания 2,6-диаминопиридина с диазотированным 5-амино-2-бутоксипиридином (неотропин) обладает бактерицидными св-вами. 2,3,6-Триаминопиридин - проявитель в фотографии, 2,3- и 2,6-диаминопиридины - реагенты для фотометрич. определения соотв. Rh и первичных аминов.
Date: 2015-07-27; view: 1258; Нарушение авторских прав