
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Добування і хімічні властивості індолу. Індиго. Добування і властивості. Лактам-лактимна таутомерія ізатину
|
|
Индол (бенз[b]пиррол)
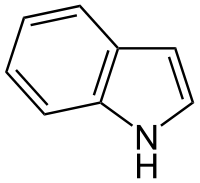
Молекула индола содержит пиррольный гетероцикл, аннелированный с бензольным кольцом. Методы синтеза индола обычно основаны на замыкании пиррольного цикла в молекуле, содержащей бензольное кольцо. Примером такой реакции является взаимодействие анилина с ацетиленом при высокой температуре (Чичибабин).
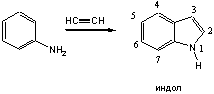
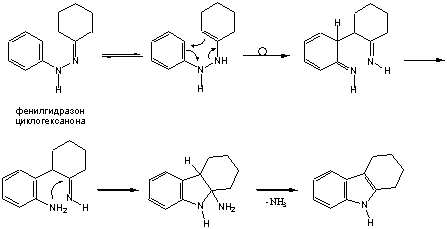
Наиболее общий способ получения индола и его производных это синтез Фишера, заключающийся в перегруппировке фенилгидразонов альдегидов и кетонов в присутствии кислотных катализаторов – хлористого цинка, трехфтористого бора, полифосфорной кислоты и др. Наиболее вероятный механизм этой реакции включает орто- бензидиновую перегруппировку, которая протекает как синхронное внутримолекулярное превращение.
Химические свойства индола аналогичны свойствам пиррола. Он практически не обладает основными свойствами, ацидофобен, является слабой NH-кислотой. Активно вступает в реакции электрофильного замещения, при этом заместитель вступает в положение 3 пиррольного кольца.

Индиго 2-(1,3-дигидро-3-оксо-2H-индол-2-илиден)-1,2-дигидро 3H-индол-3-он, (δ2,2'-бииндолин)-3,3'-дион — кристаллы фиолетового цвета.
При сульфировании получается индигокармин, его применяют как окислительно-восстановительный индикатор, для приготовления чернил,синьки, акварельных красок.
При окислении индиго азотной или хромовой кислотами образуется изатин.
Индиго синее легко восстанавливается глюкозой с образованием бесцветного лейкооснования — индиго белого, которое в отличие ог синего хорошо растворимо в воде. На воздухе очень легко идет обратный процесс — индиго белое окисляется до синего. Индиго синее имеет транс-строение, при таком расположении колец относительно двойной связи образуются ВВС между карбонильными и N H-группами.
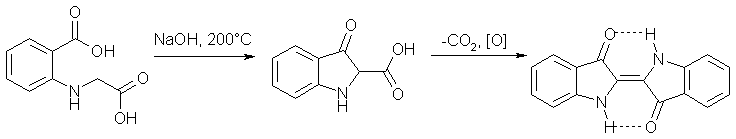
Основным промышленным методом синтеза индиго является синтез циклизацией N-фенилглицина по типу конденсации Клайзена с образованием индоксилата, который под действием кислорода воздуха окисляется до индиго:
Изатин — индол-2,3-дион
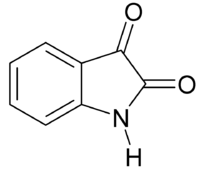
По строению представляет собой внутримолекулярный циклический амид (лактам) изатиновой кислоты. Об этом свидетельствует реакция изатина со щелочью. Нагревание натриевой соли изатиновой кислоты с хлороводородной кислотой приводит к образованию изатина.
Для изатина характерна лактан-лактимная таутомерия с преобладанием лактимной формы. В изатине имеются две карбонильные группы. Более реакционно-способной является С=0 группа в?-положении (кетонный карбонил). а-Амидный карбонил сопряжен с неподеленной парой электронов атома азота. Сопряжение приводит к повышению электронной плотности на а-атоме углерода, а следовательно, и к уменьшению ее реакционной способности в реакциях с нуклеофильными реагентами. Атом водорода группы NH в молекуле изатина подвижен и может замещаться на щелочной металл.
Номенклатура і будова п'ятичленних гетероциклів з двома гетероатомами. Ароматичність. Кислотно-основні властивості азолів. Азольна таутомерія. Реакції відновлення і заміщення у ряді азолів.


Азолы — пятичленные гетероциклы, имеющие в цикле не менее двух гетероатомов, один из которых атом азота, а также би- и полициклические соединения, включающие азольный цикл.
Основные представители - оксазол, тиазол, имидазол, изоксазол, изотиазол, пиразол, сим-триазол, тетразол, из конденсированных систем - бензимидазол бензотиазол, бенютриазол. Азолы с двумя гетероатомами, содержащие атом N в положении 2, относят к 1,2-А, в положении 3-к 1,3-А.
Все азолы -ароматические 6π-электронные системы. Для азолов, имеющих атомы Н, связанные с атомом N, характерна прототропная таутомерия.
Такие азолы - довольно сильные кислоты, образуют соли с ионами металлов, кислотность возрастает в ряду имидазол < триазол < тетразол.
В то же время все азолы -основания, образуют с кислотами азолиевые катионы, в которых сохраняется ароматическое сопряжение, с алкилирующими агентами дают четвертичные соли.
Азолы устойчивы к действию кислот и окислителей.
По отношению к электрофильным агентам они менее активны, чем их 5-членные аналоги с одним гетероатомом, но более активны, чем пиридин. Это обусловлено образованием связи электроноакцепторного атома азота с электрофильным агентом. При действии нуклеофильных агентов оксазол, тиазол, изотиазол, а также N-алкилированные имидазол и пиразол подвергаются С-депротонированию
Азолы в реакциях электрофильного замещения менее активны, чем пятичленные гетероциклы с одним гетероатомом. Следует учитывать, что азолы являются основаниями, а реакции электрофильного замещения зачастую проводят в сильнокислой среде. Это означает, что в этих условиях азолы существуют преимущественно в протонированной форме, значительно менее активной в реакциях с электрофилами, чем непротонированное соединение. Вследствие этого галоидирование азолов в отсутствие сильных кислот происходит значительно легче, чем нитрование или сульфирование. В случае 1,2-азолов электрофильное замещение происходит преимущественно по положению 4 вследствие образования наиболее устойчивого s-комплекса. 1,2-Азолы практически не вступают в реакции Фриделя-Крафтса, Вильсмайера, не реагируют с солями диазония.

Реакции электрофильного замещения в 1,3-азолах также идут преимущественно по положению 4.
Азольная таутомерия. В ряду пятичленных гетероциклов с двумя гетероатомами для пиразола и имидазола характерна азольная таутомерия. Азольная таутомерия обусловлена перемещением атома водорода гчГН-группы к атому азота пиридинового типа:
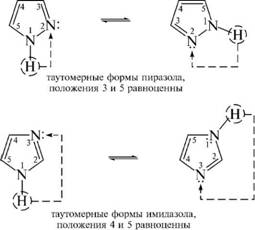
В молекулах диазолов постоянно происходит миграция водорода; и определить, у какого из атомов азота находится водород, не представляется возможным.
В результате таутомерных превращений положения 3 и 5 в молекуле пиразола становятся равноценными, 3-метилпиразол и 5-ме-тилпиразол являются таутомерными формами одного и того же соединения:

а в случае имидазола равноценными являются положения 4 и 5.
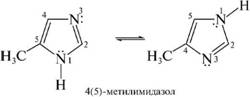
миграция водорода происходит настолько быстро, что выделить индивидуальные таутомеры не представляется возможным. Поэтому эти соединения так и называют: 3(5)-метилпиразол и 4(5)-ме-тилимидазол.
Date: 2015-07-27; view: 2495; Нарушение авторских прав