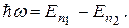Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теория Бора
|
|
В 1913 г. датский физик Нильс Бор создал первую квантовую теорию атома (Нобелевская премия 1922 г.). В основу этой теории была положена планетарная модель атома. Однако Бор высказал совершенно новые идеи относительно характера движений электронов в атоме. Он предположил, что стационарное движение электронов в атоме происходит по определенным правилам, которые были им сформулированы в виде двух постулатов.
1. Электроны в атоме могут двигаться только по некоторым "разрешенным" орбитам, названным стационарными. Причем эти орбиты можно перенумеровать. Двигаясь по одной из таких орбит, электрон вопреки законам классической электромагнитной теории не излучает электромагнитные волны. При этом его энергия Е не изменяется и принимаетодно из возможных значений, которые образуют дискретный спектр E1 ,Е2, Е3,...
Электрон за очень короткое время может перейти с одной стационарной орбиты на другую. Такой переход сопровождается испусканиемили поглощением кванта электромагнитного излучения (фотона), энергия которого  ћω равна разности энергий электрона до и после перехода:
ћω равна разности энергий электрона до и после перехода:
ћω = 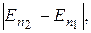 (18.7)
(18.7)
где n 1 и n 2 - номера орбит. Испускание фотона атомом происходит в том случае, когда при переходе электрона с одной орбиты на другую его энергия уменьшается. Следствием поглощения фотона атомом является переход электрона на орбиту, где его энергия больше.
Бор предложил так называемое правило квантования орбит, которому должны удовлетворять стационарные орбиты электронов в атоме. Согласно этому правилу при движении электрона по стационарной орбите его момент импульса L равен целому числу постоянных Планка ћ:
L = nћ, (18.8)
где целое число n = 1, 2, 3, … называют квантовым числом.
Теория Бора дала замечательные результаты при описании атома водорода, состоящего из протона с зарядом + е и электрона, и водородоподобного иона, который состоит из ядра произвольного элемента и одного электрона. Так как масса ядра много больше массы электрона, ядро можно считать неподвижным, а электрон - движущимся вокруг него. Заряд ядра равен +Ze, где Z - порядковый номер элемента в таблице Менделеева. Поэтому на электрон, заряд
которого равен -e, со стороны ядра будет действовать сила Кулона
F = 
где r - расстояние между ядром и электроном.
Рассмотрим движение электрона вокруг ядра по окружности радиуса r (рис. 18.6). Запишем второй закон Ньютона:
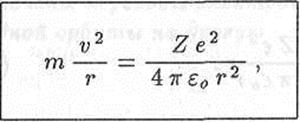
|
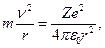 (18.10)
(18.10)
где m и v - масса электрона и его скорость.
Правило квантования (18.8) теперь можно записать так:
mvr = nћ (18.11)

Рис. 18.6. Водородоподобный ион
-e –заряд электрона, 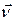 -скорость частицы,
-скорость частицы,  -сила действующая на частицу, r –радиус орбиты +Ze-заряд ядра
-сила действующая на частицу, r –радиус орбиты +Ze-заряд ядра
Второй закон Ньютона (18.10) и постулат Бора (18.11) образуют систему из двух уравнений с двумя неизвестными v и r. Найдем решение этой системы. Для этого разделим первое уравнение на второе. Получим
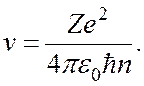
Найдем теперь радиус орбиты электрона из уравнения (18.11). После простых преобразований придем к формуле
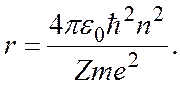
Как видно из этой формулы, радиус орбиты электрона зависит от числа п. Поэтому число п рассматривают в качестве номера орбиты. Радиус первой орбиты, для которой п = 1, в атоме водорода (Z = 1) можно вычислить по формуле

Это значение называют б оровским радиусом. Используя это обозначение, формулу для радиуса n-й орбиты электрона в водородоподобном ионе
можно записать как
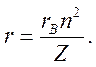
 Внутренняя энергия Е водородоподобного иона есть полная механическая энергия электрона, движущегося вокруг неподвижного ядра. Кулоновскому взаимодействию электрона с ядром соответствует потенциальная энергия
Внутренняя энергия Е водородоподобного иона есть полная механическая энергия электрона, движущегося вокруг неподвижного ядра. Кулоновскому взаимодействию электрона с ядром соответствует потенциальная энергия
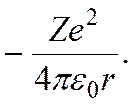
Поэтому полная механическая энергия электрона
E =  (18.12)
(18.12)
Из уравнения Ньютона (18.10)
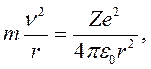
следует, что абсолютное значение потенциальной энергии электрона равно его удвоенной кинетической энергии:

Следовательно
E = 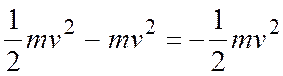
Таким образом, энергия электрона в водородоподобном ионе равна по величине и противоположна по знаку его кинетической энергии. Используя полученную выше формулу для скорости электрона, придем к следующему выражению для энергии электрона в водородоподобном ионе:
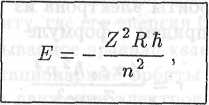
|
E = 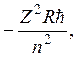
где
R = 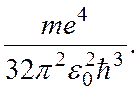 (18.13)
(18.13)
Подстановка в эту формулу известных значений фундаментальных постоянных приводит к значению R, которое с высокой точностью соответствует экспериментальному значению постоянной Ридберга. Согласно формуле (18.13) энергия электрона тем больше, чем больше квантовое число п.
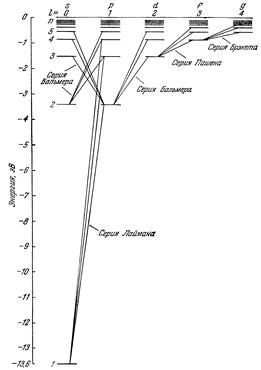
Значения энергии электрона в атоме отмечают отрезками прямых линий на числовой оси Е (рис. 18.7). Эти отрезки называют уровнями энергии электрона.
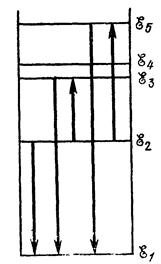
Рис. 18.7. Спектр энергий электрона в водородоподобном ионе. Стрелками условно обозначены переходы электрона с одной орбиты на другую
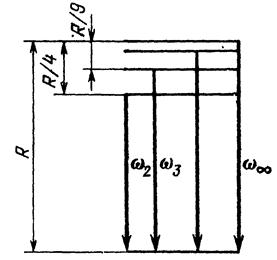
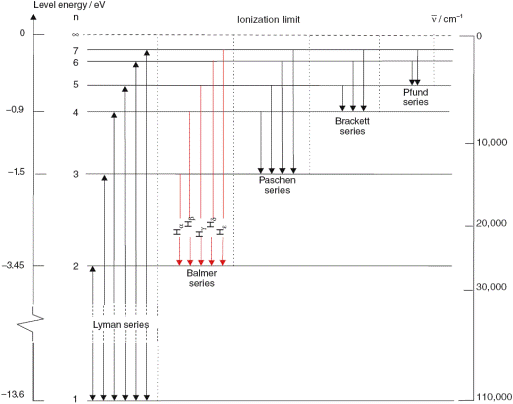
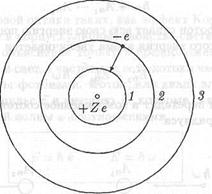
На рис. 18.8 изображены стационарные орбиты электрона в водородоподобном ионе. Когда электрон переходит на орбиту меньшего радиуса, его энергия уменьшается. При этом атом испускает фотон.
|
Рис. 18.8. Стационарные орбиты электрона в водородоподобном ионе
-e +Ze
Процесс испускания атомом фотона описывают уравнением
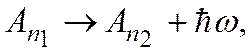
где символ Аn1 обозначает атом в состоянии, которое характеризуется квантовым числом n 1, а символ Аn2 - атом в состоянии n 2. Испускание фотона атомом подобно выстрелу снарядом из пушки (рис. 18.9).
Очевидно, что атом Аn1 может испустить фотон только в том случае, когда его энергия Еn1 больше энергии Еn2, которой он будет обладать после испускания фотона. Это условие выполняется, если n 1 > n 2. При этом энергия ћω фотона, испущенного атомом, равна разности энергий электрона в начальном и конечном состояниях:
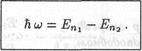
|
|
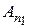
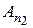 ћω
ћω

Рис. 18.9. Испускание фотона атомом
Процесс поглощения фотона атомом (рис. 18.10) описывают уравнением
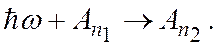
В этом процессе фотон отдает всю свою энергию поглощающему его атому. Вследствие этого энергия атома увеличивается на величину ћω:
 ,
,
где
n 2 > n 1
орбиту большего радиуса.
ћω 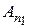
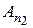
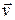

Рис. 18.10. Поглощение фотона атомом
Подставив выражение (18.13) для энергии электрона в атоме водорода (Z = 1) в равенства (18.14) и (18.15), придем к формуле (18.2) для спектра частот излучения, испускаемого или поглощаемого атомом водорода.
Атомы других химических элементов устроены более сложным образом. Атом переходит в возбужденное состояние, а электрон - на образом, чем атом водорода и водородоподобный ион. В этих атомах вокруг ядра вращаются несколько электронов. В рамках теории Бора не удается правильно описать многоэлектронный атом, даже атом гелия, в котором имеется всего два электрона.,, (Z = 1)
Date: 2015-05-19; view: 1553; Нарушение авторских прав