
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Спектр излучения атома водорода
|
|
Атом является составной частицей, т.е. он состоит из других частиц. Так же как любая система частиц, атом обладает внутренней энергией, которая складывается из кинетических энергий частиц, входящих в его состав, и потенциальной энергии их взаимодействия. При столкновениях атомов друг с другом или с какими-либо другими частицами кинетическая энергия поступательного движения частиц может переходить во внутреннюю энергию атомов. Такие столкновения называют неупругими. Когда внутренняя энергия атома увеличивается, говорят, что атом переходит в возбужденное состояние. В состояние с более низкой энергией атом может перейти самопроизвольно. При этом он испускает электромагнитные волны, уносящие часть его внутренней энергии.
В твердых телах и жидкостях атомы расположены близко друг к другу и "сильно" взаимодействуют друг с другом. Поэтому спектры электромагнитного излучения твердых тел и жидкостей существенно отличаются от спектров излучения газов, когда источниками излучения являются практически изолированные атомы. Во второй половине прошлого века были подробно исследованы спектры электромагнитного излучения, испускаемого или поглощаемого различными атомами. Схема установки для изучения спектров электромагнитного излучения изображена на рис. 18.1.
Прибор, при помощи которого исследуют спектральный состав излучения от некоторого источника, называют спектроскопом. Если спектр регистрируют на фотопластинку, то прибор называют спектрографом. Основной частью спектроскопа является призма, изготовленная из прозрачного материала, или дифракционная решетка, после прохождения которой луч света разделяется на отдельные лучи с различными длинами волн. В схеме на рис. 18.1 источником излучения 1 служит сосуд с нагретым газом или электродуговой разряд, в котором электромагнитное излучение испускается парами какого-нибудь металла. Щель 2 формирует узкий пучок параллельных лучей. Призма 3 благодаря дисперсии света, т.е. зависимости показателя преломления вещества от длины волны, производит разделение падающего луча на монохроматические лучи, идущие под разными углами. Спектр излучения наблюдают на экране 4 или регистрируют на фотопластинке.
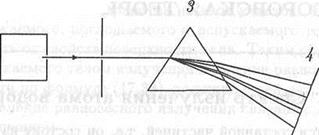
Рис. 18.1. Схема установки для наблюдения спектров излучения атомов
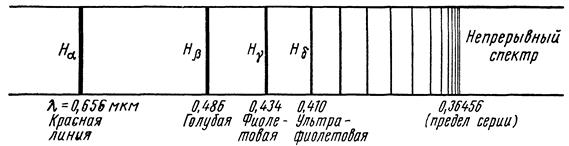
Если щель освещать белым светом, то на экране будет виден сплошной спектр, в котором присутствуют все цвета радуги от красного до фиолетового. Если же источниками света являются изолированные атомы, то на экране спектроскопа наблюдаются узкие цветные линии, разделенные черными промежутками. Такой спектр называют линейчатым. Это означает, что в электромагнитном излучении, испускаемом атомами какого-либо химического элемента, присутствуют волны не всех, а только некоторых частот (или длин волн). Причем каждому элементу соответствует только для него характерный набор частот, значения которых располагаются на числовой оси в определенном порядке. Когда электромагнитное излучение проходит через газ, его атомы поглощают волны тех частот, которые они сами могут испускать. Другими словами, спектры излучения, испускаемого и поглощаемого атомами данного химического элемента, тождественны.
В конце девятнадцатого века, когда спектры излучения различных атомов были достаточно хорошо изучены, возникла необходимость их математического описания и физического объяснения. Так исследования атомных спектров привели к появлению новых представлений в физике и рождению новой науки - квантовой механики.
В 1885 г. швейцарский физик И.Бальмер установил, что длины волн видимого света, испускаемого атомами водорода очень точно описываются формулой
λ = λ0 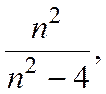
где λ0- постоянная, п = 3, 4, 5,...
В настоящее время формулу Бальмера чаще записывают в виде.
ω = R (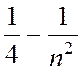 ), (18.1)
), (18.1)
где постоянную
R = 2,07 · 1016 c -1
называют постоянной Ридберга в честь шведского физика И.Ридберга. Совокупность спектральных линий, частоты которых описываются формулой (18.1), называют серией Бальмера.
В 1906 г. американский физик Т.Лайман открыл, что атомы водорода испускают также электромагнитное излучение, линии которого лежат в ультрафиолетовой части спектра. Серия частот этого излучения описывается формулой
ω = R 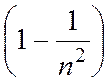 ,
,
где п = 2, 3, 4,...
Дальнейшие исследования электромагнитного излучения атомов водорода показали, что, кроме серий Бальмера и Лаймана, в нем присутствуют еще несколько серий, лежащих в инфракрасной области спектра. Все частоты излучения, которое могут испускать или поглощать атомы водорода, можно описать одной формулой
ω = R ( ), (18.2)
), (18.2)
которую называют обобщенной формулой Бальмера. В этой формуле т и п - целые положительные числа, m = 1, 2, 3, …; п > т. На рис. 18.2 изображена числовая ось ω, на которой отмечены некоторые частоты излучения атома водорода.
Серия Бальмера Серия Лаймана
Серия Бальмера Серия Лаймана
 |  |  |  |  |  | ||||||||||||||||
 |  |  |  |  | |||||||||||||||||
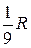

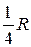
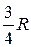 R ω
R ω
Рис. 18.2. Частоты электромагнитного излучения, испускаемого или
поглощаемого атомами водорода. Спектральные серии

Серия Бальмера
Планетарная модель атома
■
В начале XX в. существование атомов было уже общепризнано. Это знание основывалось на множестве разнообразных экспериментальных данных. Было известно, что атом представляет собой систему заряженных частиц, имеющую размер порядка 10-10 м. Был открыт электрон и установлено, что его заряд равен — е. Было известно также, что электроны входят в состав атома. Появилась необходимость в экспериментах, которые могли дать сведения о внутреннем строении атома. Задача заключалась в том, чтобы определить как распределены заряженные частицы внутри атома. Эти сведения можно было получить из экспериментов по рассеянию быстрых заряженных частиц атомами.
В 1909 - 10 годах Х.Гейгер и Э.Марсден провели эксперименты по рассеянию а-частиц в тонких металлических пленках. Схема этого эксперимента приведена на рис. 18.3.
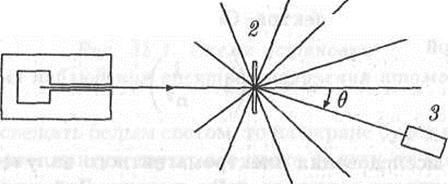
Рис. 18.3. Схема установки для изучения рассеяния а-частиц в веществе
Узкий пучок а -частиц от радиоактивного источника 1 направлялся на тонкую мишень 2 из исследуемого вещества. После взаимодействия с атомами мишени а -частицы отклонялись на различные углы относительно направления своего первоначального движения. По угловому распределению рассеянных а -частиц можно составить представление о строении атома. Количества а-частиц, отклонившихся на определенные углы, измерялись при помощи сцинтилляционного счетчика. Сцинтиллятор - это вещество, при ударе о которое а -частица вызывает вспышку света (сцинтилляцию). Эти вспышки наблюдали в микроскоп. Было установлено, что некоторое количество а -частиц при столкновениях с атомами рассеивается на очень большие углы (больше 90"), как будто внутри атома имеется "твердая" сердцевина.
Еще в 1906 г. английский физик Э.Резерфорд экспериментально доказал, что а-частица есть дважды ионизированный атом гелия, т.е. а- частица - это положительно заряженная частица, которая превращается в атом гелия, когда к ней присоединяются два электрона. Следовательно, заряд а -частицы равен +2е.
В 1911 г. Резерфорд вывел формулу, описывающую угловое распределение а-частиц после их рассеяния на положительно заряженных частицах. Эта формула с высокой точностью описывает угловое распределение а-частиц, наблюдаемое в опытах по их рассеянию атомами различных элементов. Согласие полученной формулы с результатами опытов позволило Резерфорду утверждать, что положительный заряд и почти вся масса атома сосредоточены в области, размер которой существенно меньше размеров самого атома и составляет величину порядка 10 -14 м. Эту область назвали ядром атома. Из формулы Резерфорда следовало, что заряд ядра должен быть равен +Ze, где Z - порядковый номер элемента в периодической таблице Менделеева. Резерфорд предложил рассматривать атом как некоторое подобие Солнечной системы. По его представлениям вокруг атомного ядра, как планеты вокруг Солнца, движутся Z электронов. Атом в целом нейтрален, так как отрицательный заряд всех его электронов равен по величине заряду ядра. Такая модель атома называется планетарной.
Итак, опыты по рассеянию а -частиц атомами свидетельствуют в пользу планетарной модели атома. Однако согласно законам механики и электростатики система заряженных частиц может быть устойчивой, т.е. может существовать самостоятельно длительное время, не изменяя своего состояния, только при условии, что входящие в ее состав частицы находятся в постоянном движении. Так, например, планеты не падают на Солнце и не удаляются от него на большие расстояния потому, что движутся вокруг Солнца по орбитам, похожим на эллипсы. Когда частицы движутся в пределах конечного объема, их движение непременно будет ускоренным. По законам классической электромагнитной теории ускоренно движущиеся заряженные частицы испускают электромагнитные волны, которые непрерывно уносят с собой энергию этих частиц. Следовательно, атом как система ускоренно движущихся заряженных частиц должен постоянно излучать электромагнитные волны и при этом терять свою энергию. Из этого следует парадоксальный вывод, что атом является неустойчивой системой. Разумеется, этот вывод находится в полном противоречии с действительностью. Более того, в рамках классической электромагнитной теории не удается правильно объяснить строение спектров излучения атомов. Эти противоречия обусловили необходимость формирования новых представлений и отыскания новых законов, на которых должна быть основана теория строения атома.
Открытие атомного ядра и создание Э. Резерфордом планетарной модели
атома еще более усугубило ситуацию. Дело в том, что обнаружение электрона в конце XIX в. с необходимостью приводило к выводу, что эта отрицательно заряженная частица должна входить в состав атома. Но сами атомы электрически нейтральны. Следовательно, где-то в них должен помещаться и положительный заряд. Дж.Дж. Томсон полагал, например, что положительный заряд размазан по всему объему атома в виде аморфной массы (Томсон называл ее «сферой однородной положительной электризации»),
а точечные электроны плавают в положительно заряженной среде. Однако эта модель была скорее умозрительной, нежели основанной на эксперименте, и ее пришлось пересмотреть после знаменитых опытов Резерфорда и его сотрудников, которые были выполнены в Манчестере в первом десятилетии XX в. и привели к открытию атомного ядра.
Резерфорд воспользовался тем обстоятельством, что при распаде некоторых радиоактивных веществ испускаются а-частицы, которые представляют собой, как мы знаем сейчас, ядра гелия (4Не), состоящие из двух протонов и двух нейтронов. Альфа-частицы электрически заряжены, их заряд равен +2е. В 1906 г. Резерфорд начал систематическое изучение фотографического действия а-частиц. Это исследование привело к неожиданному и чрезвычайно далеко идущему открытию. Схема первоначальных опытов была крайне проста. От радиоактивного источника α-частицы пропускались через узкое отверстие, после чего попадали на фотопластинку и давали на
ней четкое изображение щели. Резерфорд заметил, что изображение щелистановилось размытым, если стеклянный вакуумированный прибор, в котором проводились исследования, заполнить воздухом или каким-либо иным газом. Объяснение этого эффекта на первый взгляд выглядит просто: быстрая α-частица, взаимодействуя с атомами газа, слегка отклоняется от первоначального направления — происходит рассеяние. Согласиться с таким объяснением, однако, было трудно, потому что даже небольшое отклонение быстрых частиц свидетельствует о существовании больших сил, действую-
действующих на них. Оставалось неясно, откуда эти силы могут взяться в томсонов-
ском атоме, который в среднем электрически нейтрален.
Опыты Резерфорда были продолжены его учениками — X. Гейгером и У. Марсденом, которые ставили на пути пучка тонкую фольгу из различных материалов. По свидетельству Марсдена, Резерфорд однажды попросил своих сотрудников проверить, нет ли частиц, отраженных назад. Гейгер и Марсден обнаружили такие акты рассеяния: на флюоресцирующем экране, который был помещен перед мишенью-фольгой и защищен от попадания на него прямых α-частиц, хотя и чрезвычайно редко, загорались яркие
звездочки-вспышки от рассеянных примерно на 90° частиц. Наличие таких процессов было крайне удивительно в рамках существовавших представлений. Даже постулируя возможность рассеяния α-частиц на малый угол при однократном акте их взаимодействия с атомами среды, невозможно наблюдаемые события считать результатом многократных рассеяний. Вспоминая впоследствии о том впечатлении, которое на него произвели результаты наблюдений Гейгера и Марсдена, Резерфорд писал: «Это было почти столь же неправдоподобно, как если бы 15-дюймовый снаряд отразился от папиросной бумаги».
Резерфорду стало ясно, что внутри атомов должны действовать огромные силы или, иначе, в них должны существовать чрезвычайно сильные поля, которые способны отбросить назад частицу с большой энергией. Коль скоро в обратном направлении по отношению к первичному пучку отражается чрезвычайно мало частиц — одна из 8000 при опытах с платиновой фольгой, — вероятность попадания в область сильного поля, очевидно, очень мала. Отсюда следует, что большую часть атома «занимает» пустота. Интересно отметить, что соображения о пустотном строении атомов были высказаны еще
в 1903 г. немецким физиком Ф. Ленардом. Ему представлялся удивительным факт прохождения электронов (тогда они назывались катодными лучами) сквозь тонкие металлические пленки без существенного рассеяния.
Около двух лет потребовалось Резерфорду, чтобы сформулировать ответ на вопрос о том, что же представляет собой атом, и наконец в 1908 г. он пришел к вполне определенному выводу: «Поскольку масса, импульс и кинетическая энергия а-частицы очень велики по сравнению с соответствующими величинами для электрона, представляется невозможным, чтобы а-частица могла отклониться на большой угол при сближении с электроном.
По-видимому, проще всего предположить, что атом содержит центральный заряд, распределенный в очень малом объеме». Название «ядро» для этого центрального заряда было предложено Резерфордом в 1912 г. По мысли Резерфорда большинство α-частиц проходит вдали от ядра и потому мало меняет направление своего движения, но те немногие частицы, которые подходят близко к ядру, встречаются с сильным отталкиванием и потому отклоняются на большие углы.
Из классической механики хорошо известна задача о рассеянии частицы в кулоновском поле. Представим себе частицу массы га, несущую заряд q и движущуюся со скоростью v. Если такая частица при движении из бесконечности попадает в электрическое поле одноименного покоящегося точечного заряда Q, то она движется по криволинейной траектории — гиперболе, т. е. рассеивается на некоторый угол θ, величина которого связана с расстоянием, на котором частица проходит мимо силового центра, а точнее — с так называемым прицельным расстоянием b. Эта связь выражается соотношением
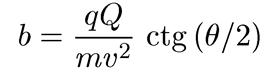
Если же на силовой центр падает однородный поток таких частиц, то можно
показать, что вероятность рассеяния на угол в в единицу телесного угла
равна
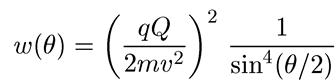 (1.5)
(1.5)
Эта формула (получившая в дальнейшем название формулы Резерфорда)
хорошо оправдывается на опыте. Отклонения от нее наблюдаются только для очень малых углов рассеяния и для углов, близких к π. Первые соответствуют большим прицельным расстояниям и объясняются (несколько забегая вперед) экранирующим действием электронов атома. Что же касается отклонений для углов, близких к π (рассеяние назад) и соответствующих малым значениям прицельного параметра, они указывают на конечные, хотя и небольшие, размеры области локализации положительного заряда атома и дают возможность оценить эти размеры. Из опытов Резерфорда и его учеников следовало, что эти размеры составляют ~ 10~12 см.
Вскоре было установлено, что электрический заряд центрального ядра (точнее, число содержащихся в нем положительных зарядов, равных по величине заряду электрона) в точности равен номеру данного элемента в периодической таблице Менделеева. В начале 1913 г. эту идею высказал голландский физик Ван ден Брук, а ее экспериментальное доказательство было получено спустя несколько месяцев молодым учеником Резерфорда Г. Мозли. Мозли выполнил серию блестящих измерений спектра рентгеновских лучей, характерных для разных элементов. Оказалось, что длина волны этих лучей систематически уменьшается по мере возрастания «атомного номера»
Z в периодической системе. Мозли пришел к выводу, что данная закономерность обусловлена увеличением заряда атомного ядра, который «возрастает от атома к атому на одну электронную единицу», и что число таких единиц «совпадает с номером места, занятого элементом в периодической таблице».
С другой стороны, атом электрически нейтрален, следовательно, отрицательный заряд электронов должен в точности компенсировать положительный заряд ядра. Это значит, что полное число электронов в атоме также равно Z. Таким образом, Резерфорд пришел к выводу, что атом похож на Солнечную систему. Ядро, имеющее размеры ~ 10~12 см, является аналогом центрального светила — Солнца, а электроны выступают в роли планет, орбиты которых обладают размерами порядка размеров атома, т. е.
~ 10~8 см. Отличие от Солнечной системы состоит в том, что положительный заряд ядра +Ze компенсируется отрицательным зарядом электронного облака —Ze, тогда как в случае сил тяготения никакой компенсации быть не может. Гравитация всегда приводит к притяжению различных тел и никогда — к отталкиванию. Планетарная модель атома была впоследствии многократно подтверждена и вскоре стала общепринятой.
Резерфорду принадлежит выдающаяся заслуга в создании планетарной модели атома. Традиционная картина этой модели с ее четким рисунком электронных орбит стала своеобразной эмблемой XX в., кочующей по книгам, выставкам, экслибрисам и т. п. На самом деле, как это выяснилось в дальнейшем, электронных орбит не существует. И все же эти рисунки — заслуженная дань резерфордовской модели, сыгравшей роль краеугольного камня в истории создания квантовой механики.
Несмотря на все успехи планетарной модели атома, ее было очень трудно объяснить с позиций классической физики. Главная неприятность состояла в том, что, согласно классической теории электромагнитных явлений, заряженный электрон, движущийся по круговой или любой другой искривленной орбите, должен все время излучать световые волны. Спектр такого излучения будет определяться частотой обращения электрона по орбите и меняться непрерывно. На опыте, напротив, атомные спектры всегда дискретны.
Кроме того, потратив свою энергию на излучение световых волн, электрон должен был бы двигаться по орбите все меньшего и меньшего радиуса —подобно спутнику Земли, тормозящемуся в ее атмосфере, — и в конце концов упасть на ядро. Такое явление, однако, отсутствует: в обычных условиях атомы вполне стабильны. Поэтому, принимая планетарную модель атома, необходимо отказаться от классических представлений. Наиболее отчетливо это понял замечательный датский физик Ни лье Бор, говоривший
позднее: «Решающим моментом в атомной модели Резерфорда было то, что она
со всей ясностью показала, что устойчивость атомов нельзя объяснить на
основе классической физики и что квантовый постулат — это единственно
возможный выход из острой дилеммы. Именно эта острота несоответствия
заставила меня абсолютно поверить в правильность квантового постулата».
Итак, в 1913 г. Нильсом Бором были выдвинуты два постулата:
1. Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются только некоторые, удовлетворяющие определенным условиям, а именно те, для которых момент импульса равен целому кратному постоянной Планка ћ:
pe r = me vr = nћ. (1.6)
Число n называется главным квантовым числом. Находясь на одной из таких орбит, электрон энергию не излучает.
2. Излучение испускается или поглощается в виде кванта энергии ћω при
переходе электрона из одного состояния с энергией Еm в другое —обладающее энергией Еn т. е.
ћωnm = Еn - Еm. (1.7)
Применим эти постулаты к атому водорода. Так как взаимодействие только кулоновское, мы имеем следующее уравнение для движения электрона с зарядом z = -е в поле протона (водородного ядра) с зарядом Z = е:

Подставив сюда скорость v из первого постулата Бора
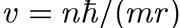 ,
,
v = nh/(mr)
получим
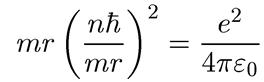
(1.9)
откуда сразу находим радиус n-й боровской электронной орбиты
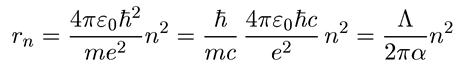 , (1.10)
, (1.10)
где
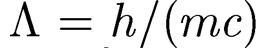
Λ= h/(mc) — так называемая комптоновская длина волны электрона,
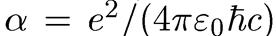
— безразмерная константа, равная 1/137 и называемая постоянной тонкой структуры (почему она получила такое название, мы увидим в дальнейшем).
Для первой водородной орбиты (самое нижнее энергетическое состояние электрона в атоме водорода, соответствующее n = 1) получаем
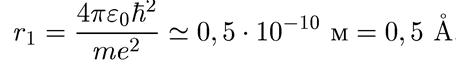
(1.11)
Эта величина (она называется боровский радиус) очень хорошо совпадает с газокинетическим размером атома водорода, известного из молекулярной физики.
Полная энергия электрона равна сумме его кинетической энергии и потенциальной энергии взаимодействия с ядром:
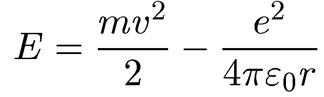
(1.12)
Но, согласно (1.8),
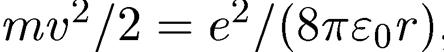 ,
,
а значит, полная энергия равна
Е = 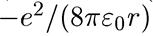
И5 подставляя сюда выражение A.10) для радиуса n-й орбиты, получаем
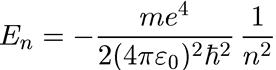
(1.13)
Теперь мы можем воспользоваться вторым постулатом Бора для вычисления спектра, излучаемого возбужденным атомом водорода. При переходе атома из состояния n1 в состояние n2 испускается квант света энергии
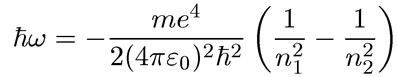
(1.14)
Итак, частота излученного света и его длина волны равны соответственно
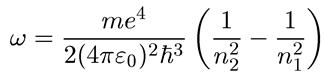
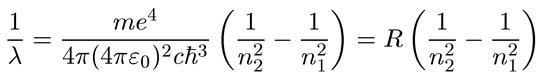
Мы видим, что на основании постулатов Бора легко получается экспериментально наблюдаемая сериальная структура спектров излучения водорода, и можем найти численное значение постоянной Ридберга:
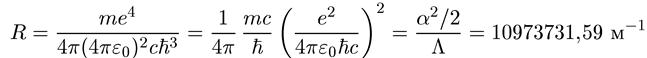
(1.16)
Оно великолепно совпадает с экспериментально измеренным значением. В
энергетических единицах постоянная Ридберга равна

что соответствует потенциалу ионизации атома водорода — переходу электрона с орбиты с n1 = 1 в область непрерывного спектра, т. е. на орбиту с n2 = oo.
В атомной физике и оптике введена, как внесистемная, единица энергии ридберг (Ry):
1Ry = 13,60 эВ, т. е. величина, практически равная энергии связи в атоме водорода.
Применение Н. Бором квантовомеханических представлений к атому явилось началом эры квантовой физики. Теперь понятен каламбур, сказанный П.Л. Капицей в 1961 г. во время последнего посещения Н. Бором Москвы: «Каждый школьник знает, что атом Бора — это не атом бора, а атом водорода».
Постулаты Бора были применены не только в случае атома водорода, но и для других атомов. В ряде сравнительно простых случаев, когда вычисления можно было довести до конца, согласие с экспериментальными данными оказалось превосходным.
Оценивая вклад Н. Бора в развитие современной физики, в 1949 г. А. Эйнштейн писал: «Мне всегда казалось чудом, что этой колеблющейся и полной противоречий основы (экспериментальных результатов по спектроскопии) оказалось достаточно, чтобы позволить Бору — человеку с гениальной интуицией и тонким чутьем — найти главнейшие законы спектральных линий и электронных оболочек атомов, включая их значение для химии. Это каэюется мне чудом и теперь. Это — наивысшая музыкальность в области мысли».
Вообще говоря, боровское квантование можно распространить не только на круговые орбиты. В общем случае оно имеет вид
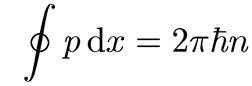 , (1.18)
, (1.18)
где интеграл взят по всей траектории классического движения частицы.
В старой квантовой теории данное соотношение носит название правило квантования Бора-Зоммерфельда (Зоммерфельд распространил квантование Бора на эллиптические обиты).
Исходя из этого правила, можно выяснить общий характер распределения уровней в энергетическом спектре. Пусть ΔЕ есть расстояние между двумя соседними уровнями, т. е. уровнями с отличающимися на единицу квантовыми числами n. Поскольку ΔЕ мало (при больших n) по сравнению с самой энергией уровней, то
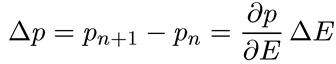
На основании соотношения (1.18) можно для n-й и (n + 1)-й орбиты записать
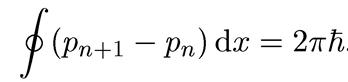
Итак, с учетом предыдущего соотношения, получаем

(1.19)
Но для классического движения производная ∂Е/∂р есть скорость частицы v, так что интеграл
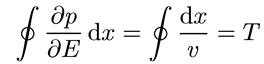
(1.20)
оказывается равным периоду движения, и мы получаем, что
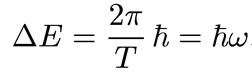
(1.21)
Таким образом, расстояние между двумя соседними уровнями оказывается
равным ћω. Для целого ряда соседних уровней (разность номеров Δn которых мала по сравнению с самими n) соответствующие частоты и можно приближенно считать одинаковыми. В результате мы приходим к выводу, что в каждом небольшом участке квазиклассической части спектра уровни расположены эквидистантно через одинаковые интервалы ћω. Такой результат, впрочем, можно было ожидать заранее, поскольку в квазиклассическом случае частоты, соответствующие переходам между различными уровнями энергии, должны быть целыми кратными классической частоты и.
Для круговой орбиты условие (1.21) можно легко получить и из постулатов Бора:
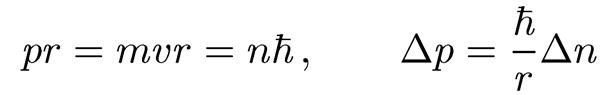
Поэтому, так как Δn = 1, то
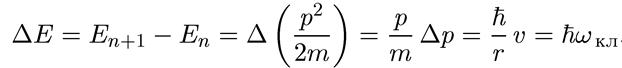
Новые взгляды на поведение микрообъектов получили свое подтверждение и в последующих опытах. Одним из весьма веских доказательств дискретности энергетических уровней атомов служат результаты экспериментов Дж. Франка и Г. Герца по возбуждению и ионизации атомов электронным ударом. Схема экспериментов Франка и Герца и качественный вид полученных ими результатов по возбуждению атомов электронами изображены на рис. 1.1. В пространстве между электродами СК происходит ускорение электронов; затем они замедляются в пространстве между электродами С А;
в пространстве СС электроны взаимодействуют с атомами, и те электроны,
которые потеряли свою энергию, не могут попасть на анод лампы. Справа показана зависимость анодного тока от приложенного между катодоми первой сеткой ускоряющего напряжения Vc. Минимумы на этой кривой соответствуют энергии возбуждения атомных уровней.
Исходя из постулатов Бора, эксперименты Франка и Герца можно интерпретировать следующим образом. Пусть атом находится в самом низком стационарном состоянии. Если энергия частицы, налетающей на такой атом, очень мала, то ее может быть недостаточно, чтобы перевести атом в более высокое стационарное состояние. (Для атома водорода, например, минимальная энергия, при которой он «возбуждается», составляет 10,15 эВ.)
В этом случае возможно лишь упругое рассеяние налетающей частицы на атоме, подобное столкновению двух бильярдных шаров. Если же энергия налетающей частицы достаточно велика, то часть ее, равная разности энергий двух стационарных состояний, может быть поглощена атомом и потрачена на его «возбуждение». Такое столкновение будет уже неупругим, однако «неупругая» потеря энергии должна быть вполне определенной.
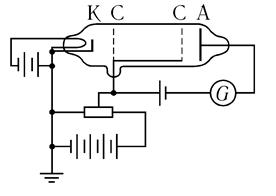

Рис. 1.1
Интересно, что сами Франк и Герц этого не понимали и в своей статье даже не упомянули о теории Бора. Правильность объяснения Бора была признана ими лишь в 1917 г. после дополнительных экспериментов.
Квантовые условия Бора являются гениальной догадкой. И хотя планетарная теория атома Бора, конечно, не была серьезной теорией, однако ее успех стал для теоретиков мощным стимулом к развитию квантовой теории атома и созданию квантовой механики.
Date: 2015-05-19; view: 4772; Нарушение авторских прав