
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Сравнительная характеристика различных типов связей
|
|
Проведенный выше анализ межатомных и межмолекулярных связей показывает, что потенциал парного взаимодействия для физически различных типов связей качественно имеет вид, представленный на рис. 4.17. На малых расстояниях при  преобладают силы отталкивания, имеющие одну природу для всех связей: они обусловлены обменным взаимодействием заполненных оболочек атомов и отталкиванием ядер. Область вблизи равновесия,
преобладают силы отталкивания, имеющие одну природу для всех связей: они обусловлены обменным взаимодействием заполненных оболочек атомов и отталкиванием ядер. Область вблизи равновесия, 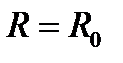 , характеризуется приблизительным балансом сил притяжения и отталкивания. В основном состоянии молекулаили кристалл находится в этой области, совершая нулевые колебания. Наконец, область
, характеризуется приблизительным балансом сил притяжения и отталкивания. В основном состоянии молекулаили кристалл находится в этой области, совершая нулевые колебания. Наконец, область 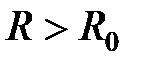 , характеризуется преобладанием сих притяжения, закон убывания которых с расстоянием сильно зависит от типа связей и описывается для ионных связей потенциалом Борна-Маделунга-Ланде, для ковалентных - потенциалом Морзе и для сил Ван-дер-Ваальса – потенциалом Леннарда-Джонса (Рис.4.17).
, характеризуется преобладанием сих притяжения, закон убывания которых с расстоянием сильно зависит от типа связей и описывается для ионных связей потенциалом Борна-Маделунга-Ланде, для ковалентных - потенциалом Морзе и для сил Ван-дер-Ваальса – потенциалом Леннарда-Джонса (Рис.4.17).
Следует иметь в виду, что в «кухне» теоретиков имеется более 30 модельных потенциалов, применяемых для расчета конкретных соединений; приведенные здесь потенциалы являются наиболее распространенными «представителями» соответствующих типов связей. Большое разнообразие
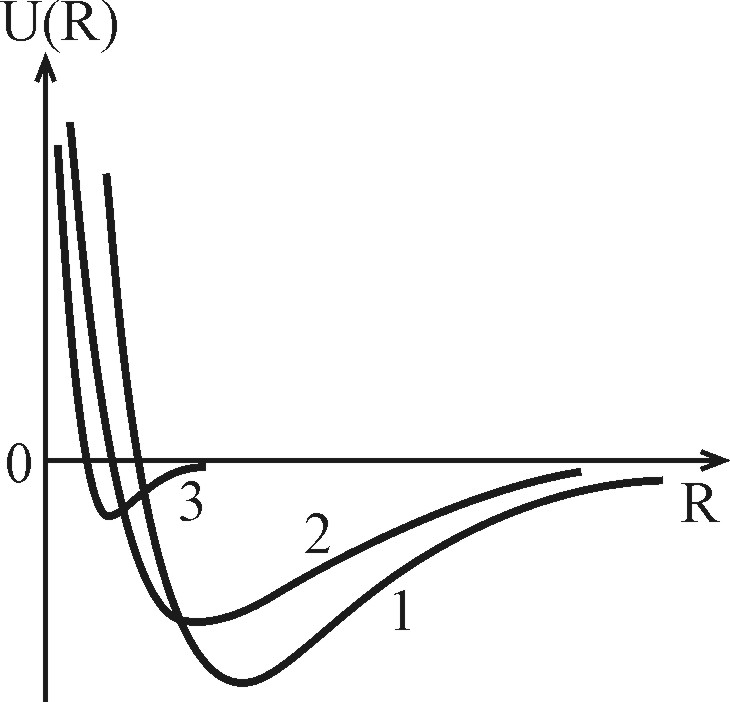
| Рис. 4.17. Потенциал парного взаимодействия для физически различных типов связей:
1) ионная связь: потенциал Борна-Маделунга-Ланде
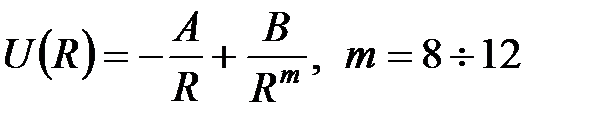 ;
2) ковалентная связь: потенциал Морзе ;
2) ковалентная связь: потенциал Морзе
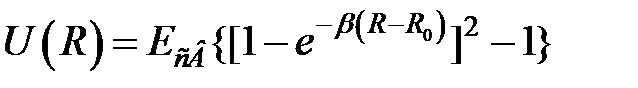 ;
3) силы Ван-дер-Ваальса: потенциал Леннарда-Джонса ;
3) силы Ван-дер-Ваальса: потенциал Леннарда-Джонса
 . .
|
потенциалов обусловлено тем, что реальная ситуация, «как всегда гораздо сложнее», и представляет собой, как правило, суперпозицию различных типов связей. Подавляющее большинство высокоомных кристаллических соединений имеют ионно-ковалентную связь, представляющую собой суперпозицию ионной и «чисто ковалентной» связей с различной степенью ионности. В переходных d-металлах металлическая связь, обусловленная коллективизацией 4 s -электронов, сочетается о ковалентной связью, возникающей между перекрывающимися незаполненными 3 d -оболочками. В ряде переходных металлов ситуация осложняется частичной гибридизацией 4 s и 3 d -электронов.
Универсальный характер сил Ван-дер-Ваальса, обусловленных понижением энергии нулевых колебаний, означает, что они не исчезают на любых расстояниях, в том числе и в области, где образуется химическая связь за счет переноса заряда между молекулами. Как правило, они дают лишь небольшую добавку к более интенсивным силам связи, ионно-ковалентной, металлическойили водородной. Важным примером исключения из этого правила является лед.
В почти линейном фрагменте 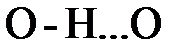 протон осциллирует вокруг положения равновесия с довольно большой амплитудой
протон осциллирует вокруг положения равновесия с довольно большой амплитудой 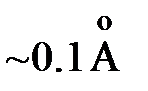 . Спектральные исследования показывают, что во льду имеются макроскопические области объемом ~мкм3, содержащие
. Спектральные исследования показывают, что во льду имеются макроскопические области объемом ~мкм3, содержащие 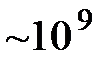 молекул, в которых протоны осциллируют синхронно с одной частотой. Между этими областями возникают силы Ван-дер-Ваальса, которые имеют порядок энергии водородных связей и вносят существенный вклад в энергетику кристаллов льда.
молекул, в которых протоны осциллируют синхронно с одной частотой. Между этими областями возникают силы Ван-дер-Ваальса, которые имеют порядок энергии водородных связей и вносят существенный вклад в энергетику кристаллов льда.
Сочетание типов связи во многом определяют физические свойства вещества. Например, ионно-ковалентный характер связи в молекуле 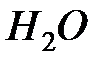 вызывает ее сильную поляризацию, что обуславливает высокую диэлектрическую проницаемость воды; с наличием водородных «мостиков» связаны разнообразные уникальные свойства воды, в том числе ее «информационная память», а силы Ван-дер-Ваальса вызывают появление особенностей в инфракрасных спектрах поглощения воды и льда и т.д.
вызывает ее сильную поляризацию, что обуславливает высокую диэлектрическую проницаемость воды; с наличием водородных «мостиков» связаны разнообразные уникальные свойства воды, в том числе ее «информационная память», а силы Ван-дер-Ваальса вызывают появление особенностей в инфракрасных спектрах поглощения воды и льда и т.д.
Деление всех моноатомных веществ на металлы и неметаллы обусловлено существованием локализованных и делокализованных связей. Локализованные связи возникают в том случае, когда валентность атомов совпадает с координационным числом, и носят преимущественно ковалентный характер. Замечательным примером этого простого правила служит олово. Оно расположено в четвертой группе периодической системы и имеет максимальную валентность, равную 4. Кристаллическое олово может существовать в двух кристаллографических модификациях: ниже 13.2 °С - «серое олово», имеющее алмазоподобную тетраэдрическую структуру с координационным числом 4, а выше 13.2 °C - «белое олово», решетка которого имеет координационное число 6. Серое олово - типичный полупроводник, по своим свойствам близкий к 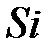 и
и 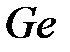 , а «белое олово» - металл.
, а «белое олово» - металл.
Если элементарная ячейка кристалла содержит разные атомы, то, как правило, возникает ионно-ковалентная связь, степень ионности которой пропорциональна разности электроотрицательностей атомов. Ионная связь прочнее ковалентной (см. Таблицу 4.1.), поэтому в соединениях с преимущественно ионной связью требуется больше энергии для образования свободных носителей заряда (электронов и дырок) путем разрыва части локализованных связей. Такие соединения являются хорошими диэлектриками. Энергии связи в соединениях с ионно-ковалентной связью соизмерима с шириной запрещенной зоны. Как известно, широкозонные кристаллы (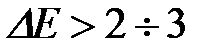 эВ, где
эВ, где 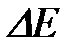 - ширина запрещенной зоны) являются диэлектриками, а узкозонные (
- ширина запрещенной зоны) являются диэлектриками, а узкозонные (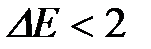 эВ) - полупроводниками. Поэтому кристаллы с преимущественно ионной связью, как правило, хорошие диэлектрики, с ковалентной связью - полупроводники, а с полностью делокализованной, металлической, соответственно - металлы.
эВ) - полупроводниками. Поэтому кристаллы с преимущественно ионной связью, как правило, хорошие диэлектрики, с ковалентной связью - полупроводники, а с полностью делокализованной, металлической, соответственно - металлы.
Интересно отметить, что в условиях всестороннего (гидростатического) сжатия любое вещество должно перейти металлическое состояние за счет коллективизации электронов глубоких атомных оболочек, т.е. «насильственный» делокализации межатомных связей. В пределе сверхвысоких давлений должно возникнуть состояние «идеального металла», решетка которого состоит из атомных ядер и заполнена коллективизированными электронами. При образовании металлической связи под давлением энергия притяжения значительно возрастает, что в некоторых случаях приводит к образованию локального минимума на кривой в области 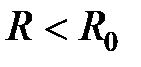 . При этом возникающая металлическая фаза может оказаться устойчивой после снятия давления.
. При этом возникающая металлическая фаза может оказаться устойчивой после снятия давления.
Такая ситуация ожидается, например, при сжатии атомарного или молекулярного водорода давлением в несколько миллионов атмосфер. Металлический водород, как полагают теоретики, должен обладать многими замечательными свойствами, в том числе сверхпроводимостью.
Несмотря на разнообразие типов связей и их сочетании в конкретных молекулах и кристаллах можно, очевидно, говорить об общей картине межатомного взаимодействия. Для ее описания удобно ввести некоторый осредненный потенциал, содержащий основные характерные области взаимодействия (Рис. 4.18). Таких областей по крайней мере четыре. Их нумерацию лучше начать с области больших расстояний, что соответствует обычной картине конденсации атомовили молекул.
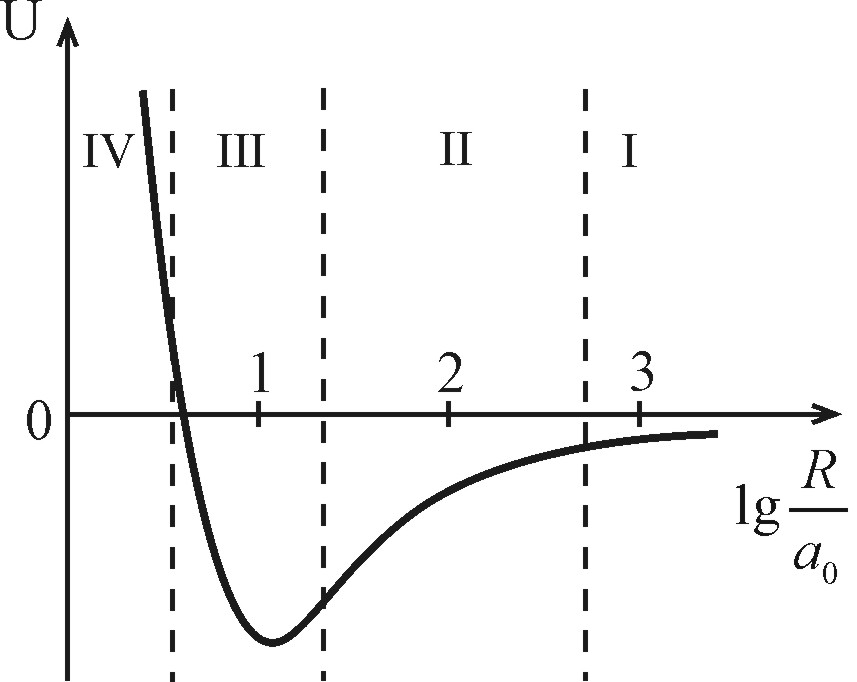
| Рис. 4.18. Классификация межатомных взаимодействий в зависимости от расстояния между атомами R |
I - силы Казимира-Польдера,  .
.
II - силы Ван-дер-Ваальса, 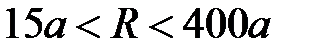 .
.
III - силы притяжения, возникающие вследствие переноса заряда (электростатические, обменные), 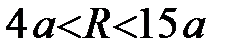 .
.
IV - силы отталкивания (обменное взаимодействие заполненных электронных оболочек и отталкивание ядер), 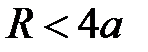 .
.
На больших расстояниях, когда еще невозможен процесс туннелирования электронов между атомами (молекулами), последние ведут себя как дипольные излучатели электромагнитных волн. Это вызвано нулевыми колебаниямиих электронных оболочек относительно положительных ядер. Электромагнитное поле излучателя, как известно из электродинамики, имеет две зоны: ближнююили квазистационарную при 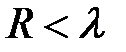 и волновую при
и волновую при 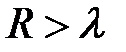 . Длину волны
. Длину волны 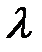 , излучаемую атомом, можно оценить из соотношения
, излучаемую атомом, можно оценить из соотношения  откуда
откуда 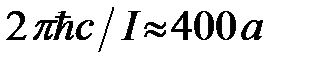 , (где
, (где 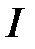 - потенциал ионизации,
- потенциал ионизации, 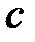 - скорость света,
- скорость света, 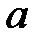 - боровский радиус). Если атомы находятся в волновой зоне
- боровский радиус). Если атомы находятся в волновой зоне 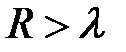 , (область I на рис. 4.18.) то между ними возникает силы притяжения Казимира-Польдера, обусловленные диполь-дипольным взаимодействием с учетом потенциалов запаздывания. Они убывают с расстоянием как
, (область I на рис. 4.18.) то между ними возникает силы притяжения Казимира-Польдера, обусловленные диполь-дипольным взаимодействием с учетом потенциалов запаздывания. Они убывают с расстоянием как 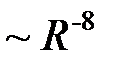 и вызывают адиабатическое сжатие газов при охлаждении. При дальнейшем сближении атомы (молекулы) попадают в ближнюю зону
и вызывают адиабатическое сжатие газов при охлаждении. При дальнейшем сближении атомы (молекулы) попадают в ближнюю зону 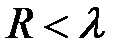 (область II, рис. 4.18.), где
(область II, рис. 4.18.), где
Таблица 4.1. Типы связей и характерные свойства вещества
| Тип связи | Вещество | Энергия связи, эВ | Характерные свойства |
| Ионная | 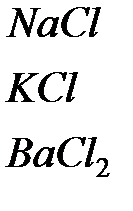
| 7.9 7.3 17.3 | Анизотропия механических свой-ств: хрупкие кристаллы при сколе и пластичные при медленном нагружении, хорошие диэлектри-ки, прозрачные в оптическом диапазоне, ионные проводники при высокой температуре и пр. |
| Ковалентная | 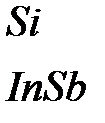
| 3.7 3.4 | Низкая сжимаемость и высокая прочность, высокая температура плавления; анизотропия механи-ческих свойств, хрупкие. Проз-рачные преимущественно в ИК-диапазоне. Полупроводники и диэлектрики |
| Металлическая | 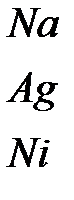
| 1.1 3.0 4.4 | Высокая упругость, пластич-ность, прочность и степень изотропности физических свойств. Высокая электро- и теплопроводность, разнообразие магнитных свойств. |
| Водородная | лед, вода | 0.5 | Полиморфизм льда, информа-ционная «память» воды, склон-ность к ассоциации молекул, отрицательный коэффициент теплового расширения воды, высокая диэлектрическая прони-цаемость и т.д. |
| Силы Ван-дер-Ваальса | 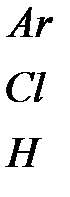
| 0.1 0.3 0.01 | Высокие диэлектрические свой-ства, низкие температуры кипения и плавления, пропор-циональные молекулярным весам и т.д. |
«господствуют» силы Ван-дер-Ваальса, которые «ответственны» за конденсацию газов, в том числе благородных, и убывают как 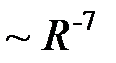 . На расстояниях
. На расстояниях 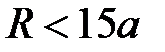 (область III) становится возможным перенос заряда за счет эффекта туннелирования валентных электронов и образование химической связи. Притяжение между атомами сильно возрастает вследствие обменного взаимодействия валентных электронов с противоположными спинами в гомоядерной молекуле либо из-за кулоновского притяжения катиона и аниона в гетероядерной молекуле. И, наконец, в области
(область III) становится возможным перенос заряда за счет эффекта туннелирования валентных электронов и образование химической связи. Притяжение между атомами сильно возрастает вследствие обменного взаимодействия валентных электронов с противоположными спинами в гомоядерной молекуле либо из-за кулоновского притяжения катиона и аниона в гетероядерной молекуле. И, наконец, в области 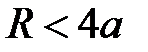 (область IV) преобладают силы отталкивания между заполненными электронными оболочками. Строго говоря, в этой области атомы теряют свою индивидуальность и взаимодействующая система должна рассматриваться как единое целое.
(область IV) преобладают силы отталкивания между заполненными электронными оболочками. Строго говоря, в этой области атомы теряют свою индивидуальность и взаимодействующая система должна рассматриваться как единое целое.
Таким образом, потенциал парного взаимодействия является ключевой характеристикой межатомного взаимодействия, позволяющей с единых позиций описывать процесс образования молекул и кристаллов. Многие физические свойства вещества «генетически» связаны с видом потенциала взаимодействия  . Например, известно, что кривизна этой функции в равновесной точке, т.е.
. Например, известно, что кривизна этой функции в равновесной точке, т.е. 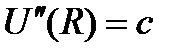 есть коэффициент жесткости упругой связи между атомами. Поэтому функция
есть коэффициент жесткости упругой связи между атомами. Поэтому функция 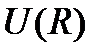 позволяет вычислять упругие константы материала в различных направлениях и построить теорию упругости, лежащую в основе механики п рочности и пластичности материалов. С другой стороны, знание упругих констант и структуры кристаллов позволяет рассчитыватьих колебательные спектры и развить теорию тепловых свойств твердых тел. Следует так же учитывать, что квантово-химическая идеология расчетов межатомного взаимодействия, имеет свое развитие в зонной теории кристаллов, в расчетах электронной структуры дефектов, их кластеров и т.д. Поэтому физика межатомного взаимодействия, выраженная в терминах парных потенциалов, такили иначе, связана со всеми разделами современной физики конденсированного вещества.
позволяет вычислять упругие константы материала в различных направлениях и построить теорию упругости, лежащую в основе механики п рочности и пластичности материалов. С другой стороны, знание упругих констант и структуры кристаллов позволяет рассчитыватьих колебательные спектры и развить теорию тепловых свойств твердых тел. Следует так же учитывать, что квантово-химическая идеология расчетов межатомного взаимодействия, имеет свое развитие в зонной теории кристаллов, в расчетах электронной структуры дефектов, их кластеров и т.д. Поэтому физика межатомного взаимодействия, выраженная в терминах парных потенциалов, такили иначе, связана со всеми разделами современной физики конденсированного вещества.
Контрольные вопросы
1. Перечислите типы связей в молекулах и твердых телах.
2. Какие типы связей является физически различными?
3. Опишите качественно кривую парного взаимодействия для физически различных типов связи.
4. Напишите потенциалы парного взаимодействия для основных типов связей.
5. Дайте определение обменной энергии. Какова ее роль в образовании ковалентной связи?
6. Какие свойства атомов определяют энергию образования молекул с ионным типом связи?
7. Почему силы Ван-дер-Ваальса действуют между любыми системами зарядов?
8. Как влияет гибридизация атомных состояний на структуру молекул и твердых тел с ковалентной связью?
9. Объясните качественно образование ковалентной связи с точки зрения соотношения неопределенностей.
10. Объясните качественно образование сил Ван-дер-Ваальса с точки зрения соотношения неопределенностей.
11. Почему энергия синглетного состояния молекулы водорода ниже энергии триплетного состояния?
12. Поясните терминологии «синглетное» и «триплетное» состояние молекулы водорода.
13. Перечислите общие черты и принципиальные различия между разными типами связи.
14. Дайте определение σ- и π-связи. Какая связь прочнее? Приведите примеры.
15. Проанализируйте соответствие типов связей с таблицей Д.И. Менделеева.
16. Какова природа водородной связи. Приведите примеры в природе.
17. Почему плотность воды максимальна при 4°С?
18. Какие свойства воды и льда обусловлены H- связью и почему?
19. Почему невозможна чисто ионная связь?
20. Чем лимитируется образование ионной связи?
21. В каком случае возможно разделение молекулы на анионы и катионы?
22. От чего зависит степень ионности гетероядерной молекулы?
23. Перечислите все возможные валентные состояния атома азота.
24. Перечислите все возможнее валентные состояния атома углерода.
25. Почему делокализация электрона энергетически выгодна?
26. Каковы общие условия возникновения локализованных и делокализованных межатомных связей?
27. Какие типы связей носят чисто квантовый характер, а какие можно описать, используя классические представления?
28. Классифицируйте твердые тела на диэлектрики, полупроводники и металлы в соответствии с типом межатомной межатомного взаимодействия.
29. Дайте краткую характеристику всем типам межмолекулярного взаимодействия.
30. Перечислите общие черты и различия сил Ван-дер-Ваальса и сил Казимира-Польдера.
31. Поясните качественную природу возникновения сил Казимира-Польдера.
32. Объясните природу притяжения макроскопических тел,не связанную с гравитацией.
33. Почему все газы при охлаждении конденсируются?
34. Почему вода замерзает с поверхности?
35. Почему ковалентная связь насыщенная и направленная, а металлическая – ненасыщенная и ненаправленная?
36. Почему в металлах координационные числа, как правило, выше, чем в соединениях с ковалентной связью?
37. На каком основании кристаллические соединения типа 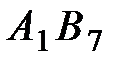 можно представить в виде решетки жестких соприкасающихся шаров разного диаметра?
можно представить в виде решетки жестких соприкасающихся шаров разного диаметра?
Литература
| 1. Блохинцев Д. И. Основы квантовой механики. М., Наука. 1983. |
| 2. Давыдов А. С. Квантовая механика. М.. Наука. 1963. |
| 3. Ландау Л. Д. Лившиц Е. М. Квантовая механика. М., Наука. 1989. |
| 4. Собельман И.И. Введение в теорию атомных спектров. М. Наука. 1977. |
| 5. Варшалович Д.А., Москалев А.А., Херсопский В.К. Квантовая теория углового момента. М. Наука. 1975. |
| 6. Коулсон Ч. Валентность. М.:Мир,1965. |
| 7. Паулинг Л. Природа химической связи. М.:Мир,1961. |
| 8. Волькенштейн М.В. Строение и физические свойства молекул. М-Л,1955. |
| 9. Каплан И.Г. Введение в теорию межмолекулярных взаимодействий. М.:Наука,1982. |
| 10. Марелл Дж., Кетлл С., Тедер Дж. Химическая связь. М.: Мир,1980. |
| 11. Заградник Р., Полак Р. Основы квантовой химии. М.:Мир,1979. |
| 12. Щустович Е.М. Химическая связь. М.:Наука, 1973. |
| 13. Замараев К.П., Хайрутдинов Р.Ф.. Жданов В.П. Туннелирование электрона в химии. М.: Наука, 1985. |
| 14. Слэтер Дж. Диэлектрики, полупроводники, металлы. М.:"Мир, 1969. |
| 15. Базилевский М.В. Метод молекулярных орбит. М.:Химия,1969. |
| 16. Грей Г. Электроны и химическая связь. М.:Мир,1967. |
Date: 2015-05-19; view: 1822; Нарушение авторских прав