
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лекция 2. Орбиталь одноэлектронной пространственной ВФ
|
|
Орбиталь одноэлектронной пространственной ВФ.
2 приближения
1. Центросимметричное поле
2. Приближение независимых частиц (орбитальное приближение)
3. Приближение Хартри
4. Определитель Слетера
5. ……
Приближение j-j (сильное спинорбитальное взаимодействие в атоме)
Квантовое число – только j
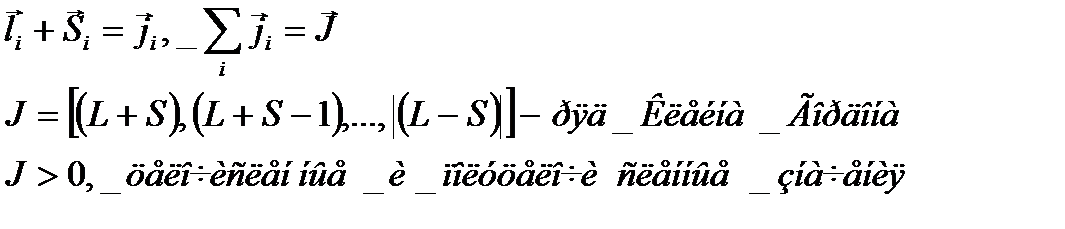
Эта схема анализа используется редко из-за неинформативности
Схема Рассела-Саундерса
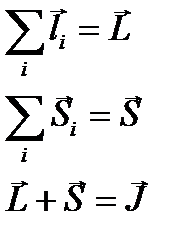
Для того, чтобы указать направление векторов складываем квантовые числа:

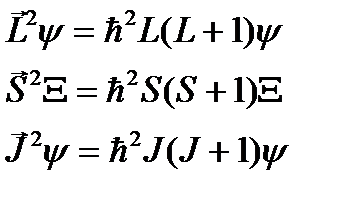
Терм состояния – символ, в котором зашифрованы основные свойства электронного состояния атома
| L | ||||
| Символ терма | S | P | D | F |
Составим таблицу для атома углерода
C: 1s22s22p2
Закрытые оболочки не учитываются
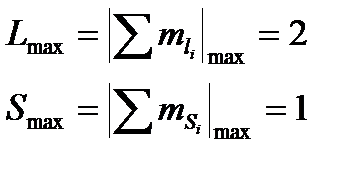
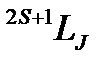

| ms | ml | -1 |  -2 -2
| |||||||
| [1+,0+] | [1+,-1+] | [-1+,0+] | ||||||||
| [1+,1-] | [1+,0-] | [1-,0+] | [-1+,1-] | [0+,0-] | [-1-,1+] | [-1+,0-] | [-1-,0+] | [-1+,1-] | ||
| -1 | [1-,0-] | [1-,-1-] | [-1-,0-] | |||||||
Анализировать таблицу нужно обязательно с крайних клеточек, поскольку максимальное знач. проекции ближе всего к значению вектора.
Правила Хунда (3)
1) Среди состояний с одной двухэлектронной конфигурацией наименьшей энергией обладает состояние с наибольшей мультиплетностью.
2) Среди состояний с одной двухэлектронной конфигурацией и мультиплетностью наименьшей энергией обладает состояние с наибольшим L
3) Для одной и той же электронной конфигурации, lля одной и той же мультиплетности, для одного и того же L наименьшей энергии соответствует уровень с наименьшим J, если оболочка заполнена меньше,чем на половину, и с наибольшим J, если оболочка заполнена больше, чем на половину.
Иногда правила Хунда нарушаются (особенно второе) у d- и f-элементов в комплексах.

Спектры щелочных элементов (схема Рассела – Саундерса)
Характеризуются 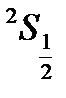
Диаграммы Гротриана

Правила отбора
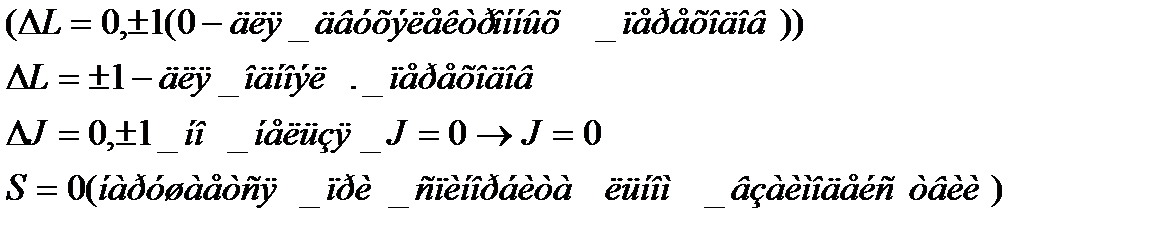
В спектрах Щелочных металлов будут серии схожие со спектрами атома водорода, но линии будут расщеплены на 2 или 3. В атоме водорода тоже можно наблюдать очень слабые дублеты.
Щелочноземельные элементы (ns2, 1S0)

Эффекты Зеемана в атомной спектроскопии.
Это взаимодействие атома с магнитным полем приводящее к изменению спектральных характеристик.
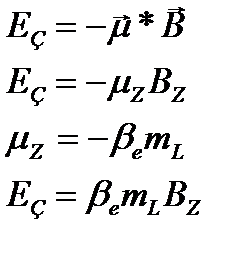
Нормальный эффект Зеемана.
Наблюдаются для атомов в синглетном основном состоянии.

Date: 2015-05-19; view: 733; Нарушение авторских прав